
Un complejo metálico es una estructura molecular en la que un átomo o ion metálico, generalmente un catión, está rodeado por cierto número de aniones o moléculas dotadas de pares solitarios.
- Por otra parte, estos complejos son llamados también compuestos de coordinación o complejos metálicos.
- Generalmente incluyen al menos un metal de transición.
- Asimismo, los iones o moléculas que rodean al metal se llaman ligandos.
Es importante destacar, que los complejos tienen múltiples aplicaciones en áreas como:
- La bioquímica en las enzimas.
- En la farmacología tratando intoxicaciones por EDTA.
- Y, para estudiar las propiedades ópticas de los complejos, los químicos utilizan la teoría del campo cristalino.
Características de un complejo metálico
Por una parte, de acuerdo a sus características, los átomos de los elementos metálicos tienden a perder electrones en las reacciones químicas en las que participan.
No obstante, estos iones metálicos con carga positiva, o cationes rara vez existen en estado libre en la naturaleza:
- Poseen una relación carga/radio tan elevada que rápidamente interactúan con otros iones, átomos o moléculas.
- Con la finalidad de adquirir una estructura que resulte temodinámicamente más estable.
Además, esto lo logra:
- Por una parte, interactuando con iones de carga negativa, lo que se traduce en una reducción de la carga total del compuesto;
- Y por otra parte, interactuando con moléculas neutras, lo que provoca un aumento del radio molecular y una consiguiente disminución de la relación carga/radio.
A la luz de lo anterior, en estas asociaciones, las moléculas que otorgan estabilidad al ión comúnmente actúan como una base de Lewis.
Es decir, poseen uno o más pares de electrones no compartidos que pueden «ceder» al catión aumentando su estabilidad.
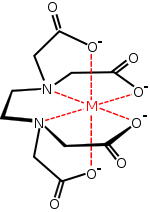
Iones complejos
Los iones complejos, son un grupo de compuestos, en los cuales un catión central es estabilizado por uno o más iones o moléculas que actúan como bases de Lewis.
Asimismo, al grupo de compuestos que los contienen se les denomina:
- Compuestos de coordinación.
Por su parte, dentro de estos compuestos de coordinación:
- A las moléculas o iones que rodean al catión central se les denomina «agentes ligantes» o simplemente «ligandos».
Los cationes metálicos
Es importante destacar, que los cationes metálicos casi siempre se encuentran en la naturaleza formando:
- Algún tipo de complejo que los estabiliza.
- Por lo general, el agente acomplejante suele ser el solvente donde se encuentra disuelto.
Estos compuestos recibieron el nombre particular de complejos, no obstante, los investigadores posteriormente llegaron a la conclusión de que la estequiometría de las reacciones estudiadas era «realmente muy compleja«.
Los ligandos
Por lo general, los ligandos son:
- Aniones.
- Moléculas polares.
- Fácilmente polarizables.
Los cuales poseen pares de electrones de valencia no compartidos, tales como por ejemplo:
- H2O.
- NH3, X-
- RCN-
Además, la unión entre catión y ligando es en principio de naturaleza electrostática. Por cuanto
- El par de electrones del ligando es intensamente atraído por la alta carga del catión.
- Forzando a la molécula o anión que lo posee a acercarse.
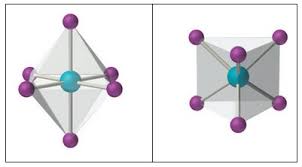
Carga y número de coordinación
La carga total del ion complejo se determina por la sumatoria de las cargas del catión central, más la de los ligantes que participan; por ejemplo en el ion ferrocianuro [Fe(CN)6], la carga del catión es +3, y cada uno de los iones cianuro posee carga -1, luego:
6 * ( − 1) + 3 = − 3,
que es la carga total del ión.
- Los ligandos se unen al ion central en la esfera de coordinación que es el lugar en el espacio donde es posible que los electrones del ligando interactúen con los orbitales vacíos del catión.
- Cada uno de los átomos del ligando que accede a la esfera de coordinación para aportar un par de electrones no compartidos se denomina átomo donador.
El «número de coordinación» de un complejo es directamente el número de átomos donadores que participan en el mismo.
Este valor depende del tamaño del catión central y del tamaño de los ligantes que participan en el complejo.
Propiedades magnéticas de un complejo metálico
En general las propiedades magnéticas de los complejos metálicos dependen del número de electrones desapareados que posea el complejo.
- Cuando haya uno o más electrones desapareados, el complejo será paramagnético y se verá atraído por los campos magnéticos en grado proporcional al número de electrones desapareados.
- Si no hay electrones desapareados, el compuesto será diamagnético y se verá ligeramente repelido por los campos magnéticos.
En el primer caso, el complejo es fuertemente paramagnético, mientras que en el segundo sólo lo es débilmente (5 e- desapareados frente a 1).
