
Las sustancias puras y mezclas constituyen la materia.
Las sustancias puras
En lo que respecta a este grupo, es importante destacar, que las sustancias puras presentan un aspecto y un comportamiento homogéneo, es decir, cualquier pedazo de un metal siempre presentará las mismas propiedades tanto física como químicas.
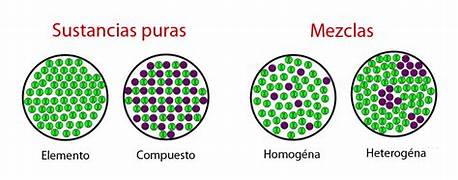
Las mezclas
Por su parte, las mezclas son materiales heterogéneos, debido a que se componen de diversos elementos con propiedades físicas o químicas que los hacen diferentes.
Asimismo, existen casos en que la naturaleza heterogénea de una mezcla se hace evidente por sus propiedades y no por su aspecto.
Sin duda, un ejemplo indudable es el agua de mar, por cuanto esta se compone de agua y sales, sin embargo, su aspecto es totalmente homogéneo, pero, al evaporarse el agua se cristalizan la diversidad de sales de la que está compuesta.
Tipos de sustancias puras
Respecto a los tipos de sustancias puras, estas se dividen en dos grandes grupos, a saber:
- En el primer grupo tenemos los elementos químicos.
- Y, al segundo grupo pertenecen, los compuestos químicos.

Elementos químicos
- En primer lugar, este tipo de elemento contiene átomos de un solo tipo.
- Por otra parte, estas sustancias no pueden descomponerse en otras más simples usando procedimientos físicos o químicos.
- Además, pocos elementos químicos se encuentran libres en la naturaleza.
- La mayoría de los elementos aparecen combinados con otros elementos químicos formando compuestos.
- Podemos afirmar, que en la actualidad se conocen 118 elementos distintos.
- Al respecto, no cabe duda que 27 de los 118 elementos han sido logrados mediante formas artificiales.
- También se comprobó, que de los elementos restantes solo la mitad se encuentran en la naturaleza.
- Es importante destacar, que cada elemento tiene un símbolo formado por 1 o 2 letras que generalmente son las siglas del nombre, por ejemplo, podemos mencionar: el Cromo (Cr), el Nitrógeno (N).
- Otros elementos se identifican con el nombre latino del elemento, ejemplo: el Fósforo (Pe), Azufre (S), Hierro (Fe).
Compuestos químicos
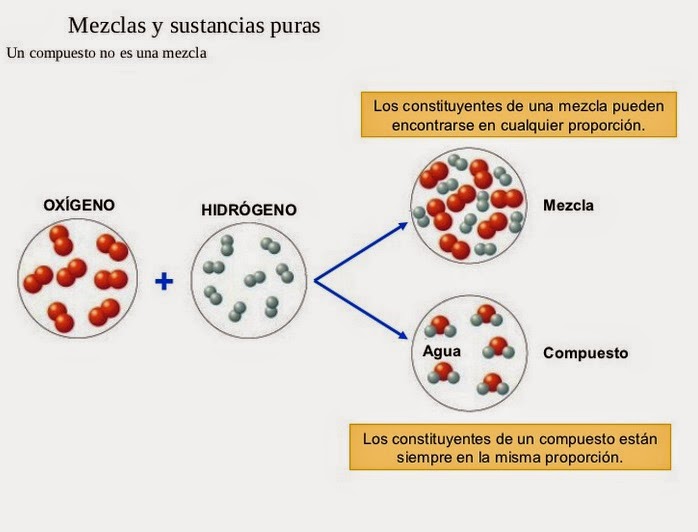
- Estos están formados por átomos combinados de distintos elementos.
- Por otra parte, podemos afirmar que los compuestos químicos tienen la posibilidad de descomponerse en sustancias más simples.
- También los compuestos están formados por moléculas.
- De acuerdo a lo antes expuesto, las moléculas pueden estar formadas de la siguiente manera:
- Por un elemento, el ejemplo clásico es el Hidrógeno (H2).También por dos elementos como el agua (H2O)
- Y, además, puede estar formado con más de dos elementos, un ejemplo de este tipo es el ácido sulfúrico (H2SO4).
- Del mismo modo, las moléculas pueden ser representadas por diversas configuraciones geométricas de acuerdo con las propiedades y la estructura de los átomos que la forman, es decir, pueden tener formas de pirámides, tetraedros, octaedros.
Las disoluciones
Se puede afirmar que una disolución es una mezcla homogénea, al respecto, debemos tomar en cuenta lo siguiente:
- No debemos confundir las disoluciones con una sustancia pura ya que las disoluciones están compuestas por la unión de diferentes sustancias puras.
- Por otra parte, las disoluciones presentan un componente mayoritario, el disolvente.
- Además, y en menor proporción están presentes en su composición los solutos.
Métodos de separación y purificación
Se puede afirmar que todas las técnicas de separación están dirigidas a:
- En primer lugar, a purificar o aislar una sustancia pura.
- Y segundo, a identificarla en una mezcla.
Por otra parte, estas técnicas se basan en el siguiente principio: “dos sustancias se podrán separar cuando tengan alguna propiedad distinta”.
Lo anterior quiere decir que, si dos sustancias se diferencian en algo, podrá idearse algún proceso que aproveche esta diferencia para efectuar la separación. Al respecto, las técnicas de separación se clasifican en:
- La volatilidad, esta se refiere a la separación por destilación.
- Además, la solubilidad, la cual ocurre debido a una separación a través de la cristalización y extracción.
- Y, por último, tenemos la adsorción, que se refiera a la separación cromatográfica.
A la luz de lo anterior, a continuación, se presentan algunos ejemplos de separación:
En primer lugar, se ha comprobado que la separación de un mineral de plomo de las piedras donde está presente, se consigue mediante la técnica llamada “flotación por espuma”.
Al respecto podemos afirmar, que a través de esta técnica se desintegra la piedra y se mezcla con alguna sustancia especial para la extracción del mineral, posteriormente se le coloca agua y se remueve produciéndose una espuma donde están adheridos los granos del mineral y los que no lo contienen van al fondo.
Otro ejemplo, es la separación de la sal del agua marina, para ello:
- En primer lugar, se deja evaporar parte del agua paulatinamente así se cristaliza solo la sal marina.
- Se debe evitar que el agua se evapore por completo, para que no se cristalicen los cloruros potásicos y magnésicos que contiene el agua de mar.
