Las reacciones químicas se fundamentan en la transformación de unas sustancias en otras, es decir, son procesos termodinámicos de transformación de la materia. Al respecto, podemos señalar que:
- En primer lugar, los átomos de las sustancias de partida, es decir, los reactivos, se fragmentan y se reorganizan.
- Mientras que las sustancias obtenidas, es decir, los productos de la reacción, aumentan su proporción a medida que desaparecen los reactivos.
- Por último, la reacción finaliza cuando los reactivos se han transformado en su totalidad.

Características de la reaccione química
En lo que respecta a las características de la reacción química podemos mencionare:
- En primer lugar, las reacciones químicas son generalmente procesos irreversibles, por cuanto se involucran la formación o destrucción de enlaces químicos entre las moléculas de los reactivos, generando una pérdida o ganancia de energía.
- Por otra parte, en una reacción química la materia se transforma profundamente, aunque en ocasiones esta recomposición no pueda apreciarse a simple vista.
- No cabe duda que las reacciones químicas generan productos determinados dependiendo de la naturaleza de los reactivos, esto depende de las condiciones en que la reacción se produzca.
- Además, en las reacciones químicas el control de su velocidad es fundamental para su empleo en la industria, la medicina.
- Asimismo, existen métodos para aumentar o disminuir la velocidad de una reacción química.
- Finalmente, las reacciones químicas se representan mediante ecuaciones químicas, las que describen los reactivos participantes y los productos que se obtienen.
Las ecuaciones de las reacciones químicas en la historia
Se puede afirmar, que el químico Jean Beguin, en el año 1615 fue quien creó la primera ecuación química de la historia en uno de los primeros tratados sobre química, el Tyrocinium Chymicum. Al respecto, la ecuación química es:
Donde:
- A y B son los reactivos.
- C y D son los productos.
- a, b, c y d son los coeficientes estequiométricos.
En lo que respecta a los estequiométricos, estos son números que indican la cantidad de reactivos y productos que deben ser ajustados para que exista la misma cantidad de cada elemento en los reactivos y en los productos.
Tipos de reacciones químicas
Las reacciones químicas pueden clasificarse según el tipo de reactivos con los que reaccionan en:
- Las reacciones químicas inorgánicas.
- Y, las reacciones químicas orgánicas.
Reacciones químicas inorgánicas.
Estas reacciones involucran compuestos inorgánicos, y pueden ser clasificadas de la siguiente forma:
- Según el tipo de transformación se clasifican en:
- Las reacciones de síntesis o adición. Dos sustancias se combinan para dar como resultado una sustancia diferente. Además, están las reacciones de descomposición. Una sustancia se descompone en sus componentes simples, o una sustancia reacciona con otra y se descompone en otras sustancias que contienen los componentes de esta.También, las reacciones de desplazamiento o sustitución. Un compuesto o elemento ocupa el lugar de otro en un compuesto, sustituyéndolo y dejándolo libre.
- Y, las reacciones de doble sustitución. Dos reactivos intercambian compuestos o elementos químicos simultáneamente.
- De acuerdo al tipo y la forma de la energía intercambiada se clasifican en:Las reacciones endotérmicas. Se absorbe calor para que la reacción pueda ocurrir. Asimismo, las reacciones exotérmicas. Se desprende calor cuando la reacción ocurre.
- Además, las reacciones endoluminosas. Se necesita luz para que ocurra la reacción. Por ejemplo: la fotosíntesis. Por otra parte, están las reacciones exoluminosas. Se desprende luz cuando ocurre la reacción.También las reacciones endoeléctricas. Se necesita energía eléctrica para que la reacción ocurra.
- Y, las reacciones exoeléctricas. Se desprende o se genera energía eléctrica cuando ocurre la reacción.
- Según la velocidad de reacción, las podemos clasificar en:
- Reacciones lentas.
- Y, las reacciones rápidas.
- Tomando en cuenta el tipo de partícula involucrada.
- Reacciones ácido-base.
- Y, reacciones de oxidación-reducción. Se transfieren electrones.
- Finalmente, según el sentido de la reacción.
- Reacciones reversibles. Se dan en ambos sentidos, es decir, los productos pueden volver a convertirse en los reactivos.
- Y, reacciones irreversibles. Se dan en un solo sentido, es decir, los reactivos se transforman en productos y no puede ocurrir el proceso contrario.
Las reacciones orgánicas

Es importante destacar, que estas involucran compuestos orgánicos, que están relacionados con la base de la vida.
Asimismo, estas reacciones dependen del tipo de compuesto orgánico para su clasificación, ya que cada grupo funcional posee un rango de reacciones específicas. Por ejemplo, los alcanos, alquenos, alquinos, alcoholes, cetonas, aldehídos, éteres, ésteres, nitrilos, entre otros.
Algunos ejemplos de reacciones de compuestos orgánicos son:
- La Halogenación de alcanos. Se sustituye un hidrógeno del alcano por el halógeno correspondiente.
- También, la combustión de alcanos. Los alcanos reaccionan con el oxígeno para dar dióxido de carbono y agua. Este tipo de reacción libera gran cantidad de energía.
- Además, la halogenación de alquenos. Se sustituyen dos de los hidrógenos presentes en los carbonos que forman el doble enlace.
- Y, la hidrogenación de alquenos. Se agregan dos hidrógenos al doble enlace, de esta forma se produce el alcano correspondiente. Esta reacción ocurre en presencia de catalizadores como platino, paladio o níquel.
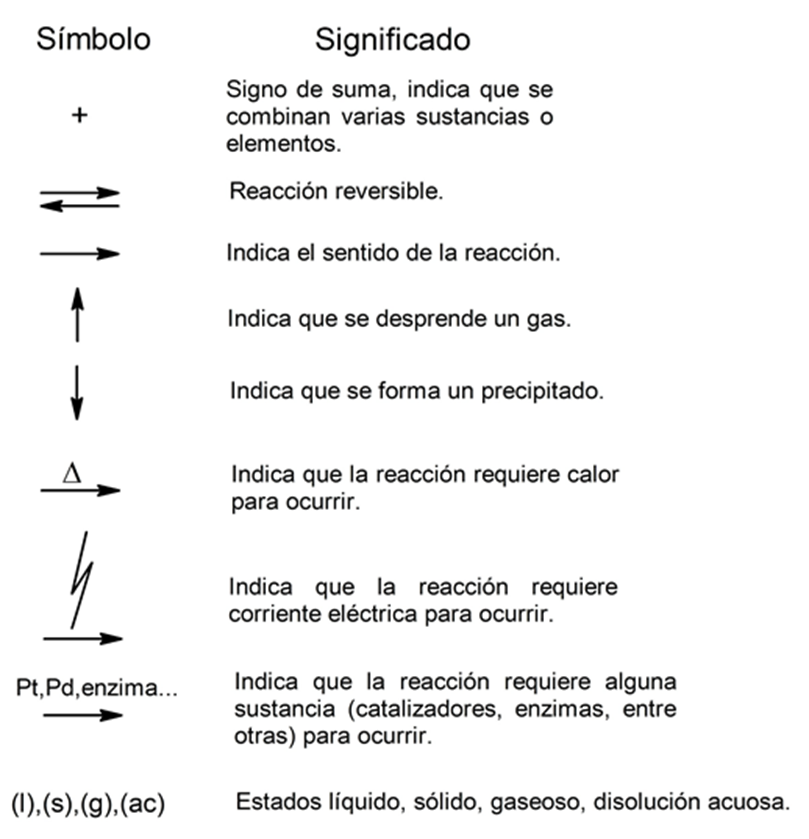
Símbolos que se utilizan para representar las reacciones mediante ecuaciones químicas: