
La cinética química es la rama de la química, encargada del estudio cuantitativo de la rapidez de reacción; entonces podemos deducir que la cinética química es la encargada, por una parte, de tratar la velocidad de una reacción, por otra parte, de los factores que influyen en ella, y finalmente del mecanismo a través del cual los reactivos se transforman en productos.
Por otra parte, se puede afirmar que la cinética química se encarga también de descubrir y describir con exactitud las reacciones intermedias, por las cuales los reactivos se convierten en productos. Al respecto, la transformación de reactivos en productos, puede ser:
- Rápida.
- También, Lenta.
- Incluso puede llegar a no suceder nunca.
- Además, algunas reacciones ocurren en un solo paso, a través de un choque simple de dos moléculas y el reordenamiento de los átomos.
- Generalmente, las reacciones suceden mediante etapas intermedias que forman en conjunto el mecanismo de la reacción.
La cinética química y la Teoría de las reacciones químicas
Es importante tomar en cuenta para entender mejor las reacciones químicas, que existen algunas teorías que explican de forma clara cómo ocurren éstas, la velocidad de las reacciones, las leyes y sus factores:
- Teoría de las colisiones.
De acuerdo con la teoría de las colisiones, una reacción tiene lugar si se cumple la siguiente condición: el choque o colisión de las partículas de los reactivos, ya sean átomos, iones o moléculas.
En este caso, los cálculos demuestran, que no es suficiente el choque de partículas para que éstas reaccionen, ya que, de ser así, todas las reacciones serían instantáneas, debido al gran número de choques que se producen en un pequeño intervalo de tiempo.
Además, explica que para que el choque de dos partículas sea garantía para provocar una reacción entre ellas, las partículas deben cumplir dos condiciones, por lo tanto, de cumplirse estas dos condiciones, el choque de las partículas será eficaz y se producirá la reacción entre ellas.
- La primera condición, tener energía cinética suficiente, como para que los enlaces se ordenen dando la formación de una sustancia nueva. De esta manera la energía cinética se transforma en energía de vibración, provocando la ruptura de los enlaces, por lo tanto, si no se posee una mínima energía cinética, las partículas rebotaran sin reaccionar.
- La segunda condición hace referencia a la colisión con buena orientación.
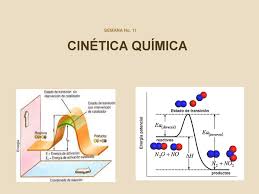
- Teoría del complejo activado.
Teoría del estado de transición
Esta teoría, también conocida como teoría del estado de transición, dice que cuando las moléculas que forman los reactivos se acercan, se deforman, provocando que el choque dé lugar a un estado intermedio de gran energía y poca duración.
Entonces podemos inferir, que el complejo activado es una mezcla de las moléculas que pueden dar lugar a los productos, y el complejo sólo se forma si las moléculas de los reactivos tienen una energía igual o mayor a la llamada, energía de activación característica de cada reacción.
La energía de activación
Al respecto, la energía de activación es la energía complementaria que deben absorber las moléculas de los reactivos, para que cuando choquen, éstas lleguen a formar el complejo activado.
Por otra parte, esta teoría refiere que la reacción sólo comienza cuando las moléculas de los reactivos llegan a la valla energética que supone la energía de activación. Por lo general, sólo una pequeña parte de las moléculas tienen la energía suficiente para superar la valla energética, por lo que, sólo esta pequeña parte, participa en la reacción.
De acuerdo a lo antes expuesto:
- Cuanto mayor sea la energía de activación, menor será la velocidad de reacción.
- En cambio, en las reacciones de baja energía de activación, se beneficia la velocidad de reacción al ser mayor el número de choques eficaces.
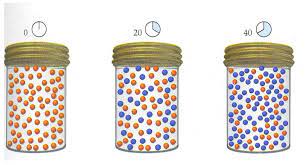
En cinética química, la velocidad de reacción, factores que afectan
Entre los factores que afectan la velocidad de reacción podemos señalar:
- La temperatura
La temperatura siempre aumenta la velocidad a la que ocurren las reacciones, ya que aumenta la frecuencia y la energía con la que las moléculas chocan entre sí. Al respecto, la dependencia de la velocidad de reacción con la temperatura viene dada por la ecuación de Arrhenius.
- Presión
Es importante destacar, que, aumentar la presión es equivalente a aumentar la concentración de todas las especies en el medio de reacción, en cuanto a las reacciones en fase gaseosa, de esta manera, los aumentos de presión tienden a aumentar la velocidad de las reacciones.
- Catalizadores
Podemos decir, que los catalizadores son sustancias químicas que se agregan al medio justamente para aumentar la velocidad de reacción. Por lo que, la mayoría de los catalizadores funcionan cambiando el mecanismo de reacción por uno que requiere una menor energía de activación.
Entre los catalizadores más comunes tenemos las enzimas en los sistemas vivos y algunos metales como el platino y el paladio.
- Inhibidores
Por su parte, los inhibidores son sustancias que hacen que las reacciones ocurran más lentamente. Entre los inhibidores más conocidos tenemos los anticorrosivos.
