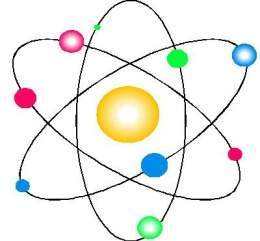
El modelo atómico de Rutherford es un modelo del átomo propuesto por Ernest Rutherford.
En 1909 se realizó el experimento de Geiger y Marsden, también conocido como el experimento de Rutherford.
Este experimento fue dirigido por el propio Rutherford.
Los resultados de modelo atómico de Rutherford
Los resultados del experimento se publicaron en un análisis de 1911 por Rutherford.
Rutherford sugirió que los primeros modelos atómicos panettone y saturniano, eran incorrectos.
En este sentido, el nuevo modelo propuesto por Rutherford tenía características que se han mantenido incluso en modelos posteriores, como:
- La concentración de la mayoría de la materia en un volumen pequeño.
- En comparación con el tamaño atómico, es decir, un núcleo atómico.
- La presencia de electrones que giran alrededor del núcleo atómico.
Sin embargo, Rutherford no dijo nada sobre el posible movimiento de los electrones.
En todo caso, sabía que su revolución alrededor del núcleo central provocaría la emisión de ondas electromagnéticas.
No obstante, a partir de su descripción, comenzó a representar el átomo de la siguiente manera:
- Con el núcleo en el centro.
- Los electrones en órbita alrededor de él.
- Y, Como los planetas del sistema solar alrededor del sol.
Debido a esta representación en particular se le conoció como modelo planetario.
Fundamentos del modelo de Rutherford
- El átomo es en su mayoría un espacio vacío.
- Rutherford negó el modelo atómico de Thompson.
- Y, confirmó la existencia del núcleo atómico, ya postulado por Nagaoka.
- Rutherford señaló que el núcleo del átomo es muy pequeño en comparación con el propio átomo.
- En el núcleo del átomo se concentraba la masa y la carga positiva del átomo.
- Esta característica equilibraba la carga eléctrica de los electrones haciéndolo eléctricamente neutro.
- Rutherford introdujo el concepto de peso atómico, que anteriormente se había omitido.
- La carga nuclear fue identificada como responsable de la dispersión de partículas alfa.
- Los electrones con carga negativa alrededor del átomo no afectan la dispersión de las partículas alfa.
El experimento de Ernest Rutherford
En 1911, Rutherford propuso su modelo de estructura atómica.
Para explicar los resultados del experimento anterior de Geiger y Marsden.
Este indicaba la presencia de una concentración de carga positiva en el centro del átomo: el núcleo atómico.
- No obstante, Rutherford propuso:
- Hacer pasar una partícula α de alta velocidad a través de un átomo de una lámina de oro que tiene una carga central positiva
- Estando rodeado por una carga de igual magnitud de electrones.
Rutherford concluyó que:
- La carga debe concentrarse en un volumen muy pequeño en relación con el tamaño atómico.
En 1913, Henry Moseley demostró que la carga nuclear era muy similar al número atómico.
Y más tarde, Antonius van den Broek sugirió que el número atómico correspondía a la carga nuclear.
Por otra parte, Rutherford mencionó el modelo atómico de Hantarō Nagaoka.
En el que los electrones estaban dispuestos en anillos, lo que demuestra que no serían estables.
El Modelo de Rutherford establecía:
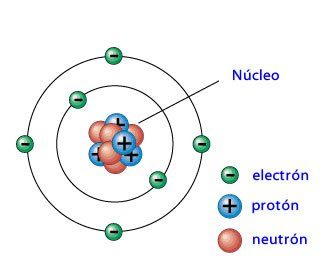
El átomo tiene un núcleo central, en el que está concentradas la carga positiva y casi toda la masa.
La carga positiva de los protones es compensada con la carga negativa de los electrones, que se hallan fuera del núcleo.
El núcleo contiene, por tanto, protones en un número igual al de electrones del átomo.
Los electrones giran a gran velocidad alrededor del núcleo
Y, están separados de éste por una gran distancia.
Rutherford supuso que el átomo estaba formado por un espacio vacío.
Que estaba ocupado por electrones que giran alrededor de un núcleo central muy denso y pequeño.
En consecuencia de todos estos interesantes descubrimientos, fue evidente para Rutherford que el modelo atómico como se conocía estaba erróneo por lo que creó uno nuevo con las siguientes consideraciones:
Principios básicos del modelo atómico de Rutherford.
- Las partículas con carga positiva se encuentran en un volumen muy pequeño comparado con el tamaño del átomo.
- La mayor parte de la masa del átomo se encuentra en ese pequeño volumen central.
- Y, Rutherford no lo llamó “núcleo” en sus papales iniciales pero lo hizo a partir de 1912.
- Los electrones con carga eléctrica negativa, giran alrededor del núcleo.
- Los electrones giran a altas velocidades alrededor del núcleo y en trayectorias circulares a las que llamó órbitas.
- Tanto los electrones cargados negativamente como el núcleo con carga positiva.
- Se mantienen unidos por una fuerza de atracción electrostática.
Aprobación del Modelo Atómico de Rutherford
Este modelo tuvo gran aceptación en la comunidad científica.
Y, vislumbró un panorama de un átomo con varias partículas subatómicas.
Científicos posteriores, pudieron determinar el número de electrones o número atómico de cada elemento.
El modelo tipo planetario de Rutherford-Bohr es la forma más sencilla de explicar el funcionamiento de un átomo:
- Con un núcleo de protones y neutrones.
- Y, electrones en órbitas girando alrededor.
