Los Números de Oxidación, llamados también Valencias; y Estados de Oxidación, son números enteros que representan:
- el número de electrones que un átomo pone en juego cuando forma un compuesto determinado.
Por otra parte:
- El número de oxidación es positivo si el átomo pierde electrones, o los comparte con un átomo que tenga tendencia a captarlos.
- Y, será negativo cuando el átomo gane electrones, o los comparta con un átomo que tenga tendencia a cederlos.
Asimismo, el número de oxidación se escribe de la siguiente manera:
+1, +2, +3, +4, –1, –2, –3, –4, …
La Valencia o números de oxidación
La valencia se refiere al número extremo de electrones presentes en la capa más externa de un átomo.
Además, se denota por carga, porque cada átomo tiene su electrón en su capa de cenefa.
Su número también indica el número de enlaces por los que puede hacer con otros elementos para satisfacer su carga.
Algunas propiedades de la valencia:
- La valencia de los elementos puros también tiene alguna carga debido a su presencia de electrón.
- Por su parte, la valencia de un átomo no cambia ni el átomo forma enlace o no.
- Además, en los elementos de los gases nobles es cero porque los gases nobles ya completan su capa de cenefa y se estabilizan.
- Esta es propiedad de un átomo aislado.
- Nunca puede ser cero.
- Por ejemplo, la valencia del sodio es uno y la valencia del magnesio es dos porque están presentes en el grupo 1A y 2A.
El estado de oxidación
El estado de oxidación, es el número máximo de electrones que gana o pierde un átomo.
El número de oxidación se refiere simplemente al número de electrones que gana o pierde un átomo.
El estado de oxidación puede ser cero.
Otras propiedades de estados de oxidación
- El número de oxidación no da la información sobre varios enlaces que puede formar con otros elementos.
- La naturaleza diferente de un átomo tiene un número de oxidación diferente.
- Existen varias reglas para encontrar el número de oxidación de un elemento.
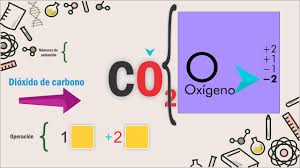
- El elemento presente en diferentes compuestos tiene un número de oxidación diferente como el átomo de oxígeno tiene un número de oxidación -2 y en los peróxidos +1 y superóxido, se indica con -½.
- El número de oxidación se refiere simplemente al número de electrones que gana o pierde un átomo.
- Está escrito en la parte superior derecha del símbolo con cargo.
- Es simplemente la indicación de los electrones que el átomo solía estabilizarse.
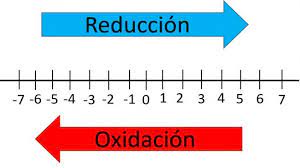
- El aumento en el número de oxidación se llama oxidación.
- Mientras que la disminución en el número de oxidación se llama reducción.
Diferencias clave
En primer lugar, la valencia es el número del electrón en la capa de valencia, mientras que el número de oxidación es la indicación del número máximo que un átomo puede ganar o perder.
Además, la valencia no se indica mediante un cargo, sin embargo, el estado de oxidación se indica mediante una carga eléctrica.
Asimismo, la Valencia nos dice el número de enlaces, mientras que el estado de oxidación no indica el número de enlaces.
La valencia del elemento puro es diferente, que puede ser cualquier carga, pero, el estado de oxidación del elemento puro es cero.
Podemos decir que, la valencia de un átomo no cambia, sin embargo, el número de oxidación varía según la presencia en diferentes compuestos.
Por una parte, la valencia no varía en un compuesto, por otra parte, el estado de oxidación de un elemento varía.
Por último, la valencia nunca puede ser cero, mientras que la oxidación puede ser cero.
Tabla Periódica con Números de Oxidación
Reglas para asignar los Números de Oxidación de los elementos:
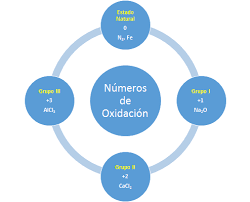
En primer lugar, el Número de Oxidación de todos los Elementos en estado Libre, no combinados con otros, es cero, por ejemplo: Na, Cu, Mg, H2, O2, Cl2, N2.
También, el Número de Oxidación del Hidrógeno (H) es de +1, excepto en los hidruros metálicos (compuestos formados por H y algún metal), en los que es de -1 por ejemplo: NaH, CaH2.
Además,el Número de Oxidación del Oxígeno (O) es de -2, excepto en los peróxidos, en los que es de -1, y en el OF2, donde es de +2.
y, el Número de Oxidación de los Metales, es su valencia con signo positivo.
- Por ejemplo, el Número de Oxidación del Mg2+ es +2.
El Número de Oxidación de los Iones monoatómicos coincide con la carga del ión.
- Por ejemplo, el Número de Oxidación del Cl- es -1
La suma algebraica de los Números de Oxidación de los elementos de un compuesto es cero.
La suma algebraica de los Números de Oxidación de los elementos de un ion poliatómico es igual a la carga del ion.
Finalmente, en los Compuestos covalentes, el Número de Oxidación Negativo se asigna al átomo más electronegativo y todos los demás son positivos.
