Los números cuánticos son el valor que se utiliza cuando se describen los niveles de energía disponibles para los átomos y las moléculas.
Al respecto, un electrón en un átomo o un ion, tiene cuatro números cuánticos:
- Tanto para describir su estado
- Como, para dar soluciones a la ecuación de ondas de Schrödinger para el átomo de hidrógeno.
Por otra parte, se utilizan cuatro números cuánticos para describir completamente el movimiento y las trayectorias de cada electrón dentro de un átomo.
La combinación de todos los números cuánticos de todos los electrones de un átomo se describe mediante una función de onda que cumple con la ecuación de Schrödinger.
Los números cuánticos y la ecuación de Schrödinger
Es importante destacar, que la ecuación de Schrödinger describió matemáticamente la naturaleza ondulatoria de los sistemas gobernados por la mecánica cuántica.
De esta manera, se dice que:
- Cada electrón de un átomo tiene un conjunto único de números cuánticos.
Según el Principio de Exclusión de Pauli:
- No hay dos electrones que puedan compartir la misma combinación de cuatro números cuánticos.
Por otra parte, los números cuánticos son importantes porque pueden utilizarse:
- Para determinar la configuración de los electrones de un átomo.
- Y la probable ubicación de los electrones del átomo.
Los números cuánticos también se utilizan para comprender otras características de los átomos, como:
- La energía de ionización.
- Y el radio atómico.
A la luz de lo anterior:
- Un átomo es la estructura definitoria de un elemento, que no puede romperse por ningún medio químico.
- Un electrón es un componente estable cargado negativamente de un átomo.
- Las moléculas se forman cuando dos o más átomos forman enlaces químicos entre sí.
- No importa si los átomos son iguales o diferentes entre sí.
Hay cuatro números cuánticos:
- n – número cuántico principal: describe el nivel de energía
- ℓ – número cuántico de momento azimutal o angular: describe la subcapa
- mℓ o m – número cuántico magnético: describe la órbita de la subcubierta
- ms o s – spin número cuántico: describe el spin
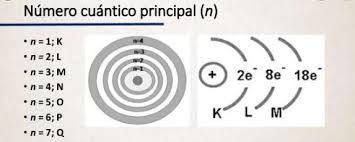
El número cuántico principal
Podemos afirmar, que el número cuántico principal, es:
El número cuántico denotado por n y que describe indirectamente el tamaño de la órbita de los electrones.
Siempre se le asigna un valor entero, como por ejemplo, n = 1, 2, 3…,
Sin embargo, su valor nunca puede ser 0.
Además, un orbital para el que n = 2 es más grande, por ejemplo, que un orbital para el que n = 1.
La energía debe ser absorbida para que un electrón sea excitado desde un orbital cercano al núcleo (n = 1) para llegar a un orbital más alejado del núcleo (n = 2).
- De esta manera, el número cuántico principal se cita primero en el conjunto de cuatro números cuánticos asociados a un electrón.
- Además, el número cuántico principal tiene el mayor efecto sobre la energía del electrón.
- También, se diseñó primero para distinguir entre los diferentes niveles de energía en el modelo del átomo de Bohr.
- Sin embargo, sigue siendo aplicable a la moderna teoría orbital atómica.
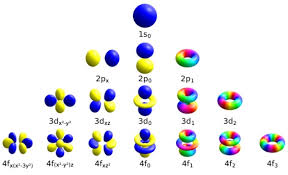
El Número Cuántico del Momento Orbital Angular (l)
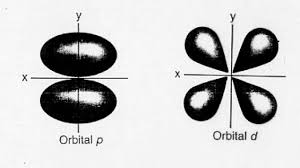
Es importante señalar, que el momento cuántico orbital angular número l determina la forma de un orbital.
Y, por lo tanto la distribución angular.
Por otra parte, el número de nodos angulares es igual al valor del momento cuántico angular número l.
Asimismo, cada valor de l, indica una subesfera específica de s, p, d, f (cada una con una forma única.)
El valor de l depende del número cuántico principal n.
A diferencia de n, el valor de l puede ser cero.
También puede ser un número entero positivo, pero no puede ser mayor que uno menos que el número cuántico principal (n-1):
l=0,1,2,3,4…,(n−1)
Los números cuánticos magnético (ml)
Hay que tener en cuenta, que el número cuántico magnético ml determina el número de orbitales y su orientación dentro de una subcubierta.
Por consiguiente, su valor depende del momento angular orbital número cuántico l.
Dado un cierto l, ml es un intervalo que va de -l a +l, por lo que puede ser cero, un entero negativo o un entero positivo.
ml=−l,(−l+1),(−l+2),…,−2,−1,0,1,2,…(l–1),(l–2),+l
Los números cuánticos, el espín de los electrones (ms)
Podemos afirmar, que a diferencia de n l y ml, el número cuántico del espín de electrones ms no depende de otro número cuántico.
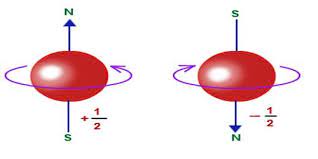
Este designa la dirección del espín del electrón y puede tener un espín de +1/2, representado por by↑, o -1/2, representado por ↓.
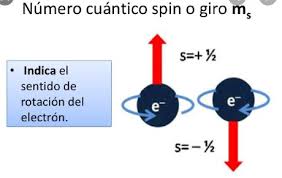
Es decir, que cuando ms es positivo el electrón tiene un espín ascendente, lo que puede denominarse «espín arriba».
Asimismo, cuando es negativo, el electrón tiene un espín hacia abajo, por lo que es «espín hacia abajo».
La importancia del número cuántico del spin del electrón es su determinación de la capacidad de un átomo para generar un campo magnético o no.
