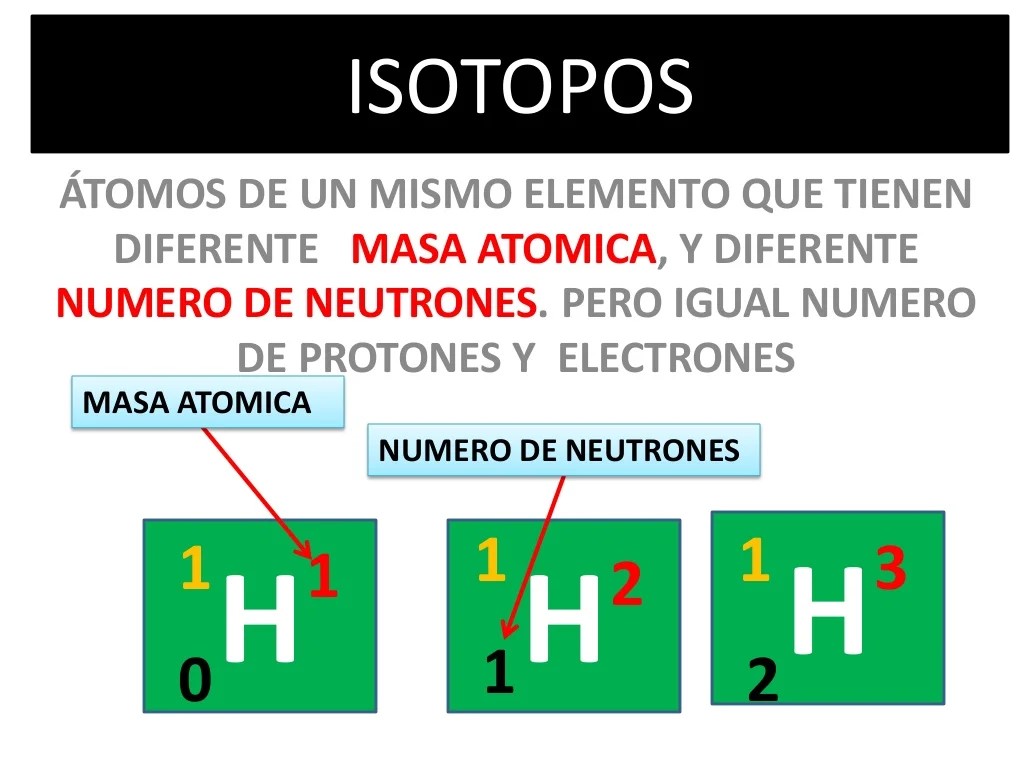
Los isótopos son átomos cuyos núcleos atómicos tienen el mismo número de protones pero diferente número de neutrones. No todos los átomos de un mismo elemento son idénticos y cada una de estas variedades corresponde a un isótopo diferente.
Los isótopos deben su nombre al término griego “isos”, que significa igual y “topos” que significa lugar.
Este término hace referencia a los átomos que pertenecen a un mismo elemento químico, no obstante, se diferencia tanto en la cantidad de neutrones, como también en la masa.
Los isótopos en la tabla periódica.
Es importante destacar que, la palabra isótopo se utiliza para indicar que todos los tipos de átomos de un elemento químico están ubicados en el mismo sitio de la tabla periódica.
Además, una gran parte de los elementos que componen la tabla periódica cuentan con varios isótopos, al respecto se puede asegurar que:
- Existen un total de 21 elementos que poseen un solo isótopo de tipo natural, entre ellos el berilio o el sodio.
- Es posible asegurar también, que el elemento químico que mayor número de isótopos posee es el estaño.
- Además, existen otros elementos como el Uranio, que, a pesar de tener isótopos de tipo natural, estos son muy inestables, y los convierte en radiactivos.
- Los isótopos inestables tienen diversas utilidades, como el poder determinar la edad de restos orgánicos, minerales. Este método de datación nos ha permitido, por ejemplo, conocer la edad de la tierra.
- Por otra parte, algunos isótopos pueden volverse inestables, como los isótopos estables del carbono, pueden volverse inestables.
Clasificación
Los isótopos pueden ser clasificados en tres categorías principales en función de su estabilidad, al respecto tenemos:
- Isótopos inestables o radiactivos.
- Isótopos estables.
- Y, los semiestables o radioisótopos
Isótopos inestables o radiactivos:
- Es importante destacar, que este tipo de isótopos son aquellos que sufren desintegración radiactiva, emitiendo partículas subatómicas o radiación para alcanzar una configuración más estable.
- Además, los isótopos radiactivos tienen un exceso o una falta de neutrones en comparación con la configuración más estable.
Algunos ejemplos son el Uranio-238, el Plutonio-239 o el Carbono-14.
Uranio-238 (238U): Es un isótopo inestable del uranio y se encuentra de forma natural en la corteza terrestre. Es el precursor del isótopo radiactivo uranio-235, que se utiliza en la producción de energía nuclear y en la fabricación de armas nucleares.
Plutonio-239 (239Pu): Es un isótopo inestable del plutonio y se produce a partir del isótopo uranio-238 en reactores nucleares. Es utilizado en la producción de armas nucleares y en reactores de fisión nuclear.
Carbono-14 (14C): Es un isótopo inestable del carbono que se forma en la atmósfera debido a la interacción de los rayos cósmicos. Se utiliza en la datación por radiocarbono para determinar la edad de objetos arqueológicos y geológicos.
Isótopos estables
Los Isótopos estables:
- En primer lugar, podemos decir que son aquellos que no experimentan desintegración radiactiva.
- Por otra parte, poseen una combinación equilibrada de protones y neutrones en su núcleo, lo que les da estabilidad a largo plazo.
Ejemplo de isótopos estables, el Carbono-12, el Oxígeno-16 o el Calcio-40.
Carbono-12 (12C): Es el isótopo más abundante del carbono en la Tierra. Se utiliza en la química orgánica como referencia para la determinación de masas moleculares y en la espectrometría de masas para la calibración de instrumentos.
Oxígeno-16 (16O): Es el isótopo más común del oxígeno y se encuentra en la atmósfera, agua y minerales. Se utiliza en la respiración celular y en la formación de enlaces químicos en muchas reacciones biológicas.
Calcio-40 (40Ca): Es el isótopo más abundante del calcio en la Tierra y se encuentra en huesos, dientes y otros tejidos. Es esencial para la contracción muscular, la coagulación sanguínea y la estructura ósea.
Hidrógeno-1 (1H): Es el isótopo más común del hidrógeno y se utiliza en una amplia gama de aplicaciones. Es esencial en la formación de moléculas biológicas, como el agua, y se utiliza en la producción de amoníaco y otros productos químicos.
Nitrógeno-14 (14N): Es el isótopo más común del nitrógeno y se encuentra en la atmósfera en grandes cantidades. Se utiliza en la síntesis de fertilizantes y en procesos de enriquecimiento de uranio.
Isótopos semiestables o radioisótopos:
- A este grupo pertenecen los isótopos que son inestables, pero tienen una vida media prolongada.
- Además, su desintegración radiactiva es más lenta en comparación con otros isótopos radiactivos.
Algunos ejemplos de isótopos semiestables:
Potasio-40 (40K): Es un isótopo semiestable del potasio que tiene una vida media de aproximadamente 1.3 mil millones de años. Se utiliza en la datación radiométrica de rocas y minerales, especialmente en la datación de rocas volcánicas.
Uranio-235 (235U): Aunque se considera un isótopo inestable, su vida media de aproximadamente 704 millones de años lo coloca en una categoría intermedia. Es utilizado en la industria de la energía nuclear como combustible en reactores nucleares y también es importante para la producción de armas nucleares.