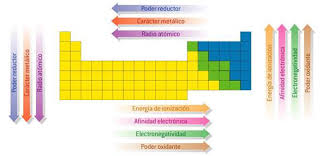
Las propiedades periódicas de los elementos químicos, son características propias de dichos elementos.
Los cuales que varían de acuerdo a su posición en la tabla periódica, es decir, en correlación con su número atómico.
Las propiedades periódicas son:

- El Electronegatividad.
- La Electropositividad.
- Además, el Radio atómico.
- También, la Afinidad electrónica.
- El Potencial de ionización.
- La densidad atómica.
- Por otra parte, el volumen atómico.
- Temperatura de fusión.
- Y, temperatura de ebullición.
Las propiedades periódicas y sus características
La es la tendencia que un átomo tiene para atraer hacia el los electrones cuando forma un enlace químico.
Electronegatividad
- La electronegatividad tiene la particularidad de no poder ser dimensionada directamente.
- Por ello, necesita de otro tipo de cálculos basados en otras propiedades atómicas o moleculares para ser determinada.
Electropositividad
Es importante destacar que, la forma de medir la electropositividad es
- Por una parte, exactamente igual que la utilizada para las mediciones inherentes a su homónimo,
- Y, mediante un enlace químico.
De la misma forma, la tendencia dentro de la tabla de elementos es contraria,
- Por cuanto mide la tendencia de un átomo en perder electrones:
- Un claro ejemplo son los metales, los cuales son los más electropositivos de la tabla.
Es importante destacar, que la electropositivitad crece en el sentido opuesto a la electronegatividad.

Es decir, de arriba hacia abajo, lo que demuestra que:
- El Francio, antes llamado eka-cesio
- El actinio K, simbolizado por Fr y de numero atómico 87
- Además, el más electropositivo de la tabla
A la luz de lo anterior, se debe considerar, que:
- Los gases nobles son demasiado inertes.
- lo que el estudio de los valores de electronegatividad
- y electropositividad no es objeto de estudio debido a la complejidad que involucra la obtención de los datos.
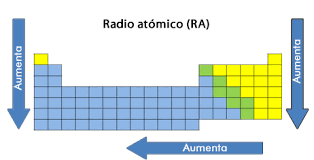
Las propiedades periódicas. Radio atómico
Al hacer referencia al radio atómico, básicamente estamos planteando:
- La posibilidad de medir la distancia entre el núcleo de un átomo.
- Y la nube de electrones que componen su capa externa.
Para ello, existen técnicas que permiten generar resultados.
Entre ellas, podemos mencionar la difracción de neutrones, de electrones o de rayos X.
- Por otra parte, esta propiedad no es fácil de medir.
- Por cuanto depende de la especie química en la que se encuentre el átomo.
Además, existen dos medidas que se pueden tomar: radios atómicos covalentes o metálicos.
En el caso de los radios covalentes nos referimos a la distancia entre los núcleos de átomos vecinos en moléculas.
En el caso del radio metálico corresponde a la mitad de la distancia entre ambos núcleos.
Por otra parte,
- El radio atómico en la familia de los elementos aumenta de arriba hacia abajo.
- Acompañada proporcionalmente de la cantidad de átomos de cada elemento.
- A mayor valor en número atómico de un elemento, mayores son las fuerzas ejercidas entre el núcleo y la electrosfera.
- Lo que se resume en un menor radio atómico.
Al respecto, la tabla nos indica que el elemento de mayor radio atómico es el Cesio.
Las propiedades periódicas. Afinidad Electrónica
- La afiniadad electrónica se basa.
- En la medición de la energía liberada por un átomo en estado fundamental.
- Y, no en estado gaseoso al recibir un electrón.
Además es la energía mínima necesaria para la liberación de un electrón perteneciente a un anión de un determinado elemento.

- Por otra parte, los gases nobles no presentan afinidad electrónica relevante,
- Además es importante recalcar que nunca igual a 0,
- Y, la adición de electrones siempre genera liberación de energía.
La afinidad electrónica no presenta una forma muy definida dentro de la tabla periódica.
- Sin embargo, su comportamiento es similar al de la electronegatividad.
- Dicho esto, la veremos crecer de abajo hacia arriba de izquierda a derecha.
El Cloro es un ejemplo claro, por cuanto posee la mayor afinidad electrónica de la tabla cerca de 350 KJ/mol
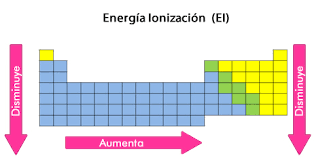
Potencial de Ionización
- El potencial de ionización mide lo inverso a la afinidad electrónica,
- Quiere decir, que mide la energía necesaria para retirar un electrón de un átomo neutro en estado fundamental.
Por otra parte, tomando en cuenta que:
- La energía necesaria para retirar el primer electrón
- Siempre es mayor que la necesaria para retirar el segundo electro
- Que a su vez es menor que la tercera y así sucesivamente.
El potencial de ionización, presenta el mismo comportamiento que la afinidad electrónica y la electronegatividad.
Lo que lleva a deducir que:
- El Flúor y el Cloro son los elementos con mayores potenciales de ionización.
- Ello, debido a que son los elementos de mayor afinidad electrónica de la tabla periódica.
