
La Valencia se refiere a la capacidad de un átomo de combinarse con otro átomo.
Los elementos cuya órbita de valencia es incompleta tienen una tendencia a completar su configuración de octeto y se acaban combinando con átomos del mismo o diferente tipo.
Por otra parte, la cifra de las valencias indica:
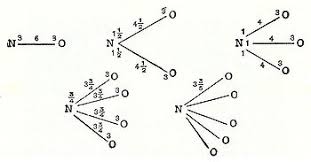
- las posibilidades que tiene un átomo a la hora de combinarse con otro para lograr constituir un compuesto.
- Esta medida está relacionada con la cantidad de enlaces químicos que establecen los átomos de un elemento de tal categoría.
Proceso que conceptualiza la Valencia
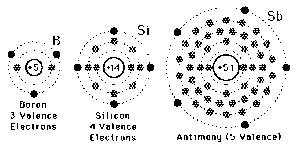
- Los electrones de un átomo se distribuyen en un área o región alrededor del núcleo.
- Dicha región tiene unos niveles de energía que forman órbitas, las cuales se representan mediante letras o bien por números.
- Así, el número de electrones presentes en la órbita más extrema es conocido, como electrones de valencia.
- La órbita más extrema se denomina a su vez órbita de valencia.
- El número máximo de electrones que se pueden alojar en la órbita más extrema es de ocho.
Debido a ello, se afirma que los elementos con una órbita extrema y totalmente completa poseen una configuración de octeto.
- Este tipo de elementos no se combinan fácilmente con otros y, en consecuencia, tienen muy poca reactividad
- En otras palabras, su capacidad para combinarse es prácticamente nula.

Los elementos cuya órbita de valencia es incompleta tienen una tendencia a completar su configuración de octeto.
Y se acaban combinando con átomos del mismo o diferente tipo.
Así, se denomina la valencia, la capacidad de un átomo de combinarse con otro átomo.
Tipos o modalidades de valencias
Las Valencias fijas:
- Solo tienen una forma de combinarse.
- Y todos sus estados son positivos.
A la luz de lo anterior, algunos de los elementos con esta característica son:
- Litio.
- Sodio.
- Potasio.
- Plata.
- Magnesio.
- Y, zinc.
Las Valencias variables
- Tienen dos o más formas de combinarse
- Entre ellas: cobre, mercurio, estaño, plomo y platino tienen esta particularidad.
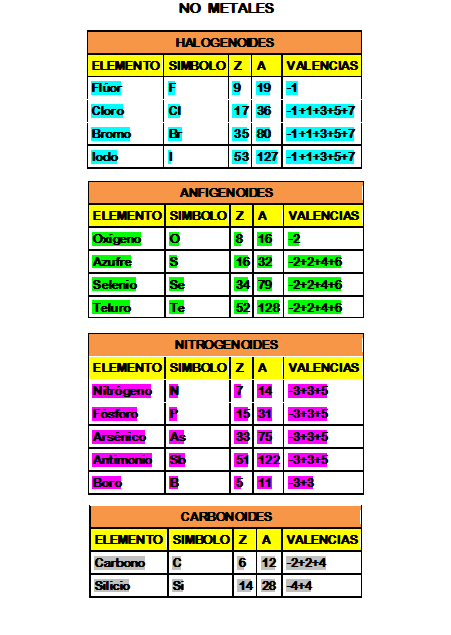
Se puede decir, que también existen las valencias fijas de los no metales:
- Por ejemplo, en el hidrógeno, flúor u oxígeno.
- Y, las valencias variables de los metales.
En todo caso, todas estas características se organizan mediante tablas donde se agrupan los diferentes elementos químicos.
En este sentido, los elementos se combinan con otros elementos de varias maneras:
- Perdiendo.
- Obteniendo.
- Compartiendo sus electrones.
Sirva de ejemplo:
La configuración electrónica del sodio (Na) es 2, 8, 1
Y, también la del cloro (Cl) es 2, 8, 7
- Para el sodio es más sencillo perder un electrón que ganar siete electrones para completar su octeto
- Por el contrario, el cloro acepta con facilidad un electrón para completar su octeto en lugar de perder siete electrones.
- Por consiguiente, tanto el sodio como el cloro poseen una valencia de 1, pues su capacidad de combinación es 1.
