La química inorgánica es la rama de la química que centra su estudio en los compuestos inorgánicos, de acuerdo con:
- La formación.
- Composición.
- Clasificación.
- Y reacciones químicas.
Es decir, de aquellos en los que no predominan los enlaces carbono-hidrógeno, típicos de la química orgánica.
Por otra parte, la diferencia entre la química orgánica y la química inorgánica no siempre es tan visible como pareciera.
Es importante destacar, que a menudo las dos áreas de estudio se solapan o comparten su campo de conocimientos.
Por otra parte, en un inicio se pensaba que la diferencia entre ambas disciplinas tenía que ver con:
- El llamado impulso vital de la química orgánica, en el entendido, que esta se usa para explicar el surgimiento de la vida.
- Sin embargo, esa hipótesis se ha desechado a medida que esto se ha ido comprendiendo mejor.
Desde otra perspectiva, en la antigüedad, se clasificaban como:
- Orgánicas a todas las sustancias compuestas por carbono que eran extraídas de las plantas y los animales.
- Y, a las sustancias extraídas de las piedras y los minerales se les llamaban inorgánicas.
Sin embargo, en la actualidad, mediante los avances científicos y tecnológicos ha sido posible sintetizar en los laboratorios químicos:
- Sustancias orgánicas, como por ejemplo, fulereno y grafeno.
Por otra parte, la química inorgánica se utiliza mucho en:
- La geología.
- También, la mineralogía.
- Asimismo, la magnetoquímica.
- Además, la geoquímica.
- Y otros campos de aplicación similares.
La química inorgánica. La clasificación de los compuestos inorgánicos
En primer lugar, es importante destacar que, las bases fuertes en disoluciones acuosas aportan iones OH–.
Razón por la cual, los compuestos inorgánicos pueden ser clasificados de acuerdo a:
El número de elementos que intervienen en la formación de cada uno de ellos, así tenemos: en compuestos binarios y compuestos ternarios.
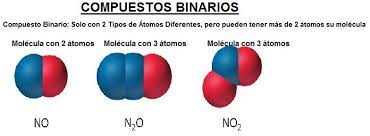
Los compuestos binarios
Compuestos binarios. Son aquellos que se componen únicamente de dos elementos químicos, tales como:
Óxidos.
- Compuestos formados por la unión del oxígeno (O2) con algún elemento metálico (óxidos básicos) o no metálico (óxidos ácidos) de la Tabla Periódica.
- Las propiedades de los óxidos son muy diversas, estos pueden encontrarse en los tres estados de agregación.
- Es decir, algunos son gaseosos, como el dióxido de carbono (CO2),
- y otros son sólidos, como el óxido de magnesio (MgO).
Peróxidos.
- Los peróxidos se forman por unión del grupo peróxido (O22-) con un elemento metálico.
- En estos compuestos el oxígeno tiene número de oxidación -1.
- Pueden ser inflamables y provocar explosiones.
Hidruros.
- Pueden ser metálicos y no metálicos.
- Los hidruros metálicos se forman por unión de un anión hidruro (H–) de carga eléctrica negativa, con un catión metálico cualquiera (carga positiva).
- Los hidruros no metálicos se forman por unión de un no metal y el hidrógeno.
- En el caso de los hidruros metálicos pueden presentar propiedades como la buena conductividad eléctrica.
- Pueden ser térmicamente inestables y provocar explosiones.
Hidrácidos o ácidos binarios.
- Son ácidos binarios compuestos por hidrógeno y un no metal diferente del oxígeno.
- Los ácidos tienen un olor característico y sabor agrio o amargo.
- Su pH es menor que 7.
- Además, son buenos conductores de electricidad cuando están en disolución acuosa.
Sales binarias:
- Son compuestos formados por conjuntos de átomos cargados eléctricamente, ya sean cationes (+) o aniones (-).
- Estas sales están compuestas por dos tipos de átomos.
- A temperatura ambiente son sólidos cristalinos de elevada temperatura de fusión y ebullición.
- Son buenas conductoras de la corriente eléctrica en solución acuosa.
Los compuestos ternarios
Compuestos ternarios. Son aquellos en los que se involucran tres elementos químicos. Tales como:
Hidróxidos.
- Son compuestos resultantes de la unión de un elemento metálico con un grupo hidroxilo (OH–).
- Son comúnmente llamados “bases” o “álcalis”.
- A temperatura ambiente son sólidos y generalmente son corrosivos.
- Reaccionan con los ácidos para producir sales.
Oxácidos.
- Son compuestos ácidos que se forman por la reacción entre un anhídrido (un óxido no metálico) y agua.
- Su fórmula siempre depende de un patrón HaAbOc, donde A es un metal de transición o un no metal, y a, b, y c son los subíndices que indican la cantidad de cada átomo.
- Estos compuestos tienen propiedades ácidas, su pH es menor que 7.
Sales ternarias.
- Son compuestos formados por conjuntos de átomos cargados eléctricamente, ya sean cationes (+) o aniones (-).
- Estas sales están compuestas por solo tres tipos de átomos.
- Sus propiedades son equivalentes a las de las sales binarias.
La química inorgánica. Ejemplos de compuestos inorgánicos
El cloro de piscina (NaClO) es una base.
Algunos ejemplos comunes de los compuestos anteriormente detallados son:
- Ácidos binarios o hidrácidos. Ácido fluorhídrico (HF(ac)), ácido clorhídrico (HCl(ac)).
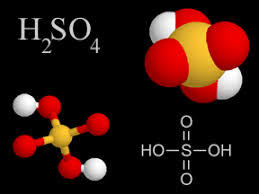
- Oxácidos. Ácido sulfúrico (H2SO4), ácido carbónico (H2CO3), ácido sulfuroso (H2SO3).
- Hidruros metálicos. Hidruro de Litio (LiH), hidruro de berilio (BeH2).
- Hidruros no metálicos. Fluoruro de hidrógeno (HF(g)), cloruro de hidrógeno (HCl(g)).
Bases.
- Hidróxidos. Hidróxido de sodio (NaOH), bicarbonato de sodio (NaHCO3).
- Óxidos metálicos. Óxido cuproso u óxido de cobre (I) (Cu2O), óxido ferroso u óxido de hierro (II) (FeO).
- Óxidos no metálicos. Dióxido de carbono (CO2), monóxido de carbono (CO)
- Sales binarias. Cloruro de sodio (NaCl), bromuro de potasio (KBr), tricloruro de hierro o cloruro de hierro (III) (FeCl3)
- Sales ternarias. Nitrato de sodio (NaNO3), sulfato de sodio (Na2SO4).
