La configuración electrónica de los elementos, se comenzó a relacionar en la tabla periódica en el año 1920, por el físico danés Niels Bohr.
Al respecto, los elementos pertenecientes al mismo grupo, poseen configuraciones electrónicas diferentes.
En base a ello, los elementos de los diferentes átomos se han clasificado en 4 diferentes bloques.
Sin embargo, en ocasiones se suele representar la configuración electrónica en forma condensada o reducida.

En este sentido, se utilizan los símbolos entre corchetes, que sustituyen a la configuración electrónica de gas noble anterior más cercano al elemento.
Por otra parte, la configuración electrónica representa la ocupación de orbitales por parte de los electrones.
Sin embargo, no el orden de llenado de los mismos.
Como ejemplo, podemos mencionar la configuración del sodio:
[Ne] 3s1 es equivalente a 1s2 2s22p6 3s1
La configuración electrónica de los Elementos del Bloque S
Es importante destacar, que a este bloque de elementos pertenecen todos los átomos de los grupos:
- 1 metales alcalinos
- Y, 2 los alcalinotérreos, con la excepción del Helio.
Por otra parte, en este bloque de elementos, los átomos del grupo 1 poseen valencia 1.
Es decir, tienen un electrón en su capa más externa y será el involucrado en el enlace atómico.
Si denominamos el nivel correspondiente al período como n, todos poseen la configuración ns1.
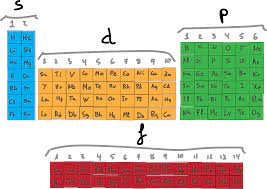
La configuración electrónica de los Elementos del Bloque S Elementos del Bloque P
Los elementos de este bloque son aquellos en los que los orbitales p con el nivel más alto de energía están ocupados.
A este conjunto pertenecen los elementos de los grupos:
- 13 térreos.
- 14 carbonoideos.
- 15 nitrogenoideos, pnictogenos.
- 16 calcógenos, anfígenos.
- 17 halógenos.
- Y, 18, gases nobles con excepción del Helio que pertenece al bloque s.
En negrita se señalan los electrones de la última capa o capa más externa (valencia).
Elementos del Bloque D
A este bloque pertenecen los metales de transición, es decir, todos los elementos de los grupos 3, 4, 5, 6, 7, 8, 9, 10, 11 y 12.
Es preciso destacar, que los grupos 6 y 11 presentan excepciones de llenado en su configuración electrónica debido a:

- Que los orbitales llenos y semi-llenos son más estables
- Y hacen al segundo electrón del orbital s promocionar al d.
Elementos del Bloque F
Debemos indicar, que a este bloque de elementos pertenecen:
- Los Lantánidos.
- Y, Actínidos.
Por otra parte, su configuración electrónica no es tan fácil de recordar ya que hay numerosas excepciones.
No obstante, para describirlas se deben seguir las mismas normas de llenado que se han visto hasta ahora.
