La asignación de números de oxidación debe guiarse de ciertas normativas que permiten realizar el cálculo de asignación de número de oxidación.
En primer lugar, veamos el concepto de estados de oxidación:
- Los estados de oxidación de un elemento son números que indican, en un compuesto iónico binario simple,
- El número de electrones que gana o pierde un átomo de dicho elemento al formar el compuesto.
En especies con enlaces covalentes, los números de oxidación no tienen el mismo significado físico que en los compuestos iónicos.
Sin embargo, son de gran ayuda para poder escribir las fórmulas químicas de las sustancias.
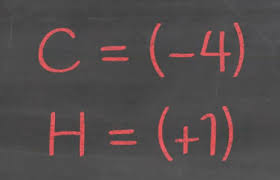
Por otra parte, un mismo elemento puede actuar con diferentes estados de oxidación, eso dependerá del compuesto del cual se encuentre formando parte.
A continuación tienes las normas que se aplican para la determinación del número de oxidación de los átomos de un compuesto.
Es importante recordar, que el número de oxidación es necesario para determinar, en una reacción de oxidación reducción:
- Qué elemento se está oxidando o semirreacción de oxidación.
- Y qué elemento se está reduciendo o semirreacción de reducción.
Reglas para la determinación del número de oxidación
Es importante destacar, que existe cierta normativa para el cálculo de asignación de número de oxidación. Entre ellas:
El número de oxidación de un elemento libre es cero. Por ejemplo los metales no disueltos (Cu, Zn, Al…) o los gases diatómicos (O2, Cl2, F2…).
En los iones de un único átomo, el estado de oxidación o número de oxidación de dicho átomo coincide con la carga del ion. Por ejemplo, en el caso de los alcalinos catiónicos el estado de oxidación es +1 (Li+, Na+, K+…) y en el caso de los alcalinotérreos +2 (Ca+2, Mg+2…). Del mismo modo será para los demás metales, por ejemplo, en el Fe(II) el estado de oxidación es +2 y en el Fe(III) +3.
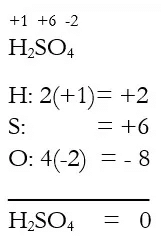
El número de oxidación del flúor, F, es siempre -1, por ser el átomo más electronegativo que existe.
El número de oxidación del oxígeno es siempre -2, con dos excepciones:
Cuando el oxígeno se combina con flúor, su número de oxidación es +2.
Otras reglas
Cuando el oxígeno se halla formando un peróxido, como el peróxido de hidrógeno o agua oxigenada, H2O2, su número de oxidación es -1.
El número de oxidación del hidrógeno es siempre +1, excepto en los hidruros metálicos que es -1 (por ejemplo hidruro sódico, HNa).
Algunos elementos tienen distinto estado de oxidación en función del compuesto que están formando. Por ejemplo, el estado de oxidación del nitrógeno en el monóxido de nitrógeno, NO, es +2, mientras que el estado de oxidación del nitrógeno en el dióxido de nitrógeno, NO2, es +4.
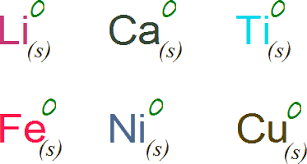
La suma algebraica de los números de oxidación de los elementos de un compuesto ha de ser igual a su carga, es decir:
Si es un compuesto neutro, la suma algebraica de sus números de oxidación será cero.
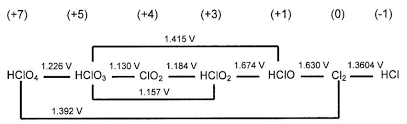
Si es un catión o un anión será igual a la carga del Ion. Por ejemplo, en el caso del anión perclorato, ClO3–, la suma algebraica de los números de oxidación será -1.
En este caso, el oxígeno tiene estado de oxidación -2, por lo que (-2)·3 = -6.
De este modo, para que la suma algebraica sea -1, el estado de oxidación del cloro ha de ser +5.
Ejemplos de asignación de número de estados de oxidación
- I2: en esta sustancia simple el número de oxidación del iodo es cero, de
- Cl2O: en esta sustancia el número de oxidación del oxígeno es -2. Como la suma de los números de oxidación de todos los átomos debe ser igual a cero, entonces el cloro actúa con número de oxidación +1.
(+1) . 2 -2 (+1) . 2 + (-2) = 0
Cl2 O
- FeO: en esta sustancia el número de oxidación del oxígeno es -2. Como la suma de los números de oxidación de todos los átomos debe ser igual a cero, entonces el hierro actúa con número de oxidación +2.
+2 -2 +2 + (-2) = 0
Fe O
- HClO4: en esta sustancia el número de oxidación del oxígeno es -2 y el del hidrógeno es +1. Como la suma de los números de oxidación de todos los átomos debe ser igual a cero, entonces el cloro actúa con estado de oxidación +7.
+1 +7 (-2).4 +1 + 7 + (-2) . 4 = 0
H Cl O4
Más ejemplos de asignación de números
- FeH3: en este caso, la sustancia es un hidruro metálico, por lo tanto, el número de oxidación del hidrógeno es -1. Como la suma de los números de oxidación de todos los átomos debe ser igual a cero, entonces el hierro actúa con estado de oxidación +3.
+3 (-1) . 3 +3 + (-1) . 2 = 0
Fe H3
- SO4-2: en este caso, tenemos un ion poliatómico, en el cual el número de oxidación del oxigeno es -2. La suma de los números de oxidación debe ser igual a la carga del ion, es decir, -2, por lo tanto, el azufre actúa con estado de oxidación +6.
+6 (-2) . 4 +6 + (-2) . 4 = -2
S O4
- NaCl: en este caso, tenemos un compuesto iónico, ya que está formado por un metal (el sodio) y un no metal (el cloro). El número de oxidación de cada elemento es igual a la cantidad de electrones que gana o pierde en la unión, entonces, el sodio actúa con número de oxidación +1 y el cloro, -1.
