El isótopo especies de un mismo elemento. Dentro de cada elemento químico existen varias especies atómicas que difieren en su masa atómica.
Estas especies de un mismo elemento se llaman isótopos
Una especie atómica viene definida por dos números enteros:
- El número de protones que hay en el núcleo y el número total de protones más neutrones.
El primero, llamado número atómico, Z, define el elemento químico al que pertenece el átomo.
- Es decir, independientemente del número de neutrones que posean, todos los átomos cuyos núcleos tienen un protón son átomos de hidrógeno.
- Por su parte, todos los que tienen ocho protones son átomos de oxígeno.
El segundo número, denominado número másico, A, es el número entero más próximo a la masa.
Expresada ésta en unidades de masa atómica del átomo en cuestión:
- Es decir, todos los átomos con A igual a 2 tienen una masa de, aproximadamente, 2 unidades másicas.
- Los que tienen A = 235, tienen una masa de unas 235 unidades de masa atómica.
Dentro de cada elemento químico existen varias especies atómicas que difieren en su masa atómica.
Estas especies de un mismo elemento se llaman isótopos.
El isótopo
Hay que tener en cuenta, que existen varias especies atómicas que:
Tienen el mismo número atómico pero poseen números másicos distintos.
Es decir, que dentro de cada elemento químico existen varias especies atómicas que difieren en su masa atómica.
Por consiguiente, estas especies de un mismo elemento se llaman isótopos.
Su nombre deriva de los términos: isos: igual y topos: lugar.
Es decir, que estos átomos ocupan el mismo lugar en la tabla periódica de los elementos.
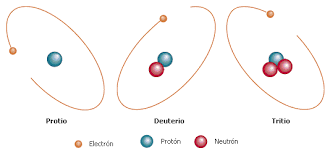
Por ejemplo, el hidrógeno tiene tres isótopos:
- El isótopo con A=1, denominado protio, es decir, que carece de neutrones.
- Un isótopo con A=2, llamado deuterio, o que posee 1 neutrón.
- Y, el isótopo con A=3, denominado tritio, porque posee 2 neutrones.
De acuerdo a lo antes expuesto, se conoce como isótopo:
Las variedades de átomos que tienen el mismo número atómico y que, por lo tanto, constituyen el mismo elemento aunque tengan un diferente número de masa.
Los átomos que son isótopos entre sí tienen idéntica cantidad de protones en el núcleo y se encuentran en el mismo lugar dentro de la tabla periódica.
Cabe destacar que gran parte de los elementos químicos cuentan con más de un isótopo.
Del total de elementos de la tabla periódica, apenas veintiún de ellos, como el sodio, tienen un único isótopo natural.
Por otra parte, es posible dividir los isótopos en isótopos estables e isótopos no estables o radiactivos.
Los isótopos se emplean en la medicina para el desarrollo de distintos estudios.
El isótopo y el aporte de Soddy
Es importante resaltar, que fue a principios del siglo XX cuando el científico inglés Frederick Soddy lo utilizó por primera vez el término isótopos.
Al respecto, podemos decir que Soddy forma parte a la historia de la química, entre otras, por:
- Descubrió y dio nombre al isótopo.
- Y, también por haber llevado a cabo importantes investigaciones sobre los elementos radioactivos y la naturaleza del isótopo.
- Este y otros hallazgos le llevaron a obtener en 1921 el Premio Nobel de Química.
- Le fue otorgado el Doctor Honoris Causa de la Universidad de Oxford en el año 1910.
Isótopos radiactivos
Es importante destacar, que para que un isótopo sea radiactivo, en primer lugar,debe exhibir una proporción entre su cantidad de neutrones y de protones que no resulte propicia para mantener la estabilidad del núcleo.
Por otra parte, la noción de estabilidad, no es muy precisa.
Ya que, hay isótopos que se consideran casi estables gracias a un tiempo de neutralización extremadamente largo.
Por su parte, el isótopo radiactivo cuenta con un núcleo atómico inestable ante el equilibrio existente entre los protones y los neutrones.
Esta misma característica hace que emita energía cuando muta de forma hacia condiciones más estables.
Los isótopos no estables experimentan un periodo de desintegración donde la energía es emitida como rayos beta, alfa o gamma.
Aquellos isótopos radiactivos artificiales son utilizados en la medicina con diversas funciones, como la detección de bloqueos en los vasos sanguíneos. Los isótopos radiactivos naturales, por su parte, se utilizan para establecer cronologías.
