
Los enlaces covalentes, metálicos e iónicos, son enlaces primarios, mientras que los enlaces secundarios son las interacciones dipolo-dipolo, enlaces de hidrógeno, entre otros.
Es importante destacar, que el enlace covalente se produce entre los dos no metales.
Por su parte, el enlace metálico se produce entre dos metales.
Y, el enlace iónico se produce entre el metal y el no metal.
- El enlace covalente implica compartir electrones.
- Mientras que los enlaces metálicos tienen fuertes atracciones.
- Y, los enlaces iónicos implican la transferencia y aceptación de electrones desde la capa de valencia.
Los enlaces químicos
Es importante destacar, que son la propiedad adherente de un átomo para organizarse en un patrón más estable al llenar la órbita de sus electrones más externos.
Por otra parte, esta asociación de átomos forma:
- Por una parte las moléculas.
- También forma los iones o cristales.
Esto se conoce como enlace químico.
Hay que tomar en cuenta, que existen dos categorías de enlaces químicos en el terreno de su fuerza, estos son:
- Los enlaces primarios o fuertes.
- Y, los secundarios o débiles.
Por su parte, los enlaces primarios son los enlaces covalentes, metálicos e iónicos.
Mientras que los secundarios son las interacciones dipolo-dipolo, enlaces de hidrógeno, entre otros.
Los enlaces covalentes
El enlace covalente se observa en un elemento que se encuentra hacia la derecha de la tabla periódica que no son metales.
Además, los covalentes implican el intercambio de electrones entre los átomos.
La igualación del electrón compartido produce una nueva órbita alrededor de los núcleos de los dos átomos llamados molécula.
Por otra parte, existen fuertes atracciones electrostáticas entre los dos núcleos de un átomo.
Y, el enlace se forma cuando:
- La energía total durante el enlace es menor que la energía que era antes.
- Sea esta como átomos individuales o valores electronegativos cercanos.
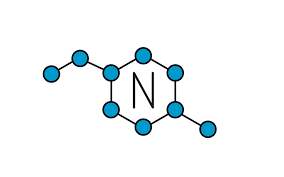
Del mismo modo, los covalentes también se conocen como moleculares:
- El Nitrógeno (N2).
- Hidrógeno (H2).
- También el Agua (H2O).
- Amoníaco (NH3).
- Además, el Cloro (Cl2).
- Y, el Flúor (F2).
Los anteriores elementos, son algunos de los ejemplos de los compuestos que tienen enlaces covalentes.
Es posible afirmar, que compartir electrones permite que los átomos obtengan la configuración estable de la capa externa de electrones.
Tipos de enlaces covalente
Existen dos tipos de enlaces covalentes:
- Los polares.
- Y, los no polares.
A la luz de lo anterior, podemos decir que, esta división se basa en la electronegatividad.
Por cuanto, en los no polares.
- Primero, los átomos comparten el mismo número de electrones ya que los átomos son idénticos.
- Y, además tienen una diferencia de electronegatividad menor que 0.4.
Sirva de ejemplo, el agua que tiene la fórmula como H2O, el agua:
- En este ejemplo, el enlace covalente está entre cada molécula de hidrógeno y oxígeno.
- Es decir, donde dos electrones se comparten entre hidrógeno y oxígeno, uno de cada uno.
De acuerdo con esta fórmula:
- La molécula de hidrógeno, el H2 contiene dos átomos de hidrógeno que están unidos por el enlace covalente con el oxígeno.
- Estas son las fuerzas atractivas entre los átomos que ocurren en la órbita más externa de los electrones.
Los metálicos
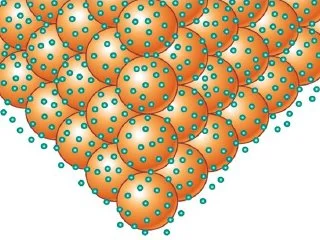
Es importante destacar, que los enlaces metálicos, son el tipo de enlace químico que se forma entre:
- Los metales.
- Metaloides.
- Y, aleaciones.
Al respecto, el enlace se forma entre los átomos con carga positiva, donde el intercambio de electrones tiene lugar en las estructuras de los cationes.
Asimismo, estos se consideran buenos conductores de calor y electricidad.
- Por otra parte, en este tipo de enlaces, los electrones de valencia se mueven continuamente de un átomo a otro.
- Esto sucede, a medida que la capa más externa de electrones de cada átomo de metal se superpone a los átomos vecinos.
A la luz de lo anterior, podemos decir que en el metal, los electrones de valencia se mueven de manera continua de un lugar a otro en todo el espacio.
Asimismo, en 1900 Paul Drude denominó el mar de electrones, a la presencia de los electrones deslocalizados o libres de los electrones de valencia.
Finalmente, las diversas propiedades características de los metales son:
- En primer lugar, tienen altos puntos de fusión y ebullición.
- Luego, son maleables y dúctiles.
- También, son buenos conductores de la electricidad.
- Y, además, fuertes enlaces metálicos y baja volatilidad.
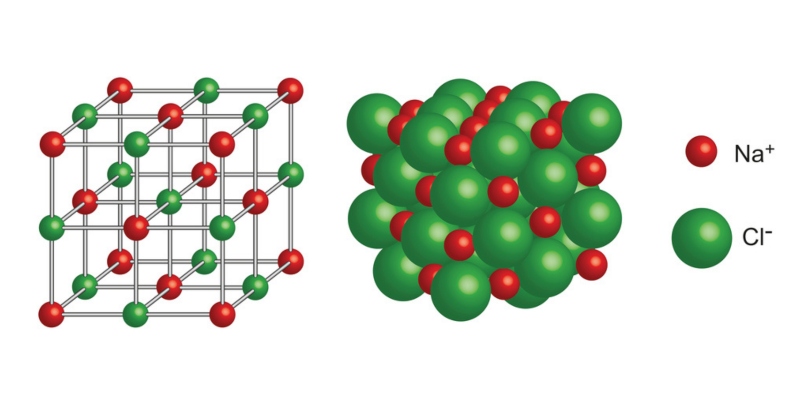
Los iónicos
En primer lugar, debemos señalar que:
- Los enlaces iónicos se definen como los enlaces entre el ion positivo y el ion negativo.
- Y, que tienen la fuerza de atracción electrostática fuerte.
Asimismo, es necesario destacar:
- Que a los enlaces iónicos también se les denominan enlaces electrovalentes.
Además, el átomo que gana o pierde uno o más electrones se llama ion.
- En este sentido, el átomo que pierde los electrones alcanza la carga positiva y se conoce como ion positivo.
- Mientras que el átomo que gana los electrones alcanza la carga negativa y se llama ion negativo.
Se ha comprobado, que en este tipo de enlace:
- Los iones positivos son atraídos hacia los iones negativos.
- Y, los iones negativos son atraídos hacia los iones positivos.
Entonces podemos decir que:
- Los iones opuestos se atraen entre sí.
- Y, los iones similares se repelen.
De acuerdo a esto, los iones opuestos se atraen entre sí y forman el enlace iónico debido a la presencia de una fuerza electrostática de atracción entre los iones.
