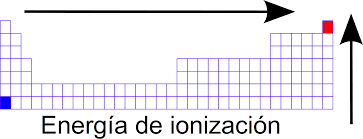
La energía de ionización es la energía necesaria para eliminar electrones de un átomo.
También es denominada potencial de ionización.
- Es importante destacar, que la ionización es el fenómeno por el cual cambia el número de electrones de un átomo.
- Por otra parte, la ionización se produce aplicando alta energía a los átomos en forma de potencial eléctrico o radiación.
- Para los átomos individuales en el vacío, existe una constante física vinculada con el proceso de ionización.
- Desde otra perspectiva, los enlaces químicos locales, la geometría y la temperatura influyen en la ionización.
- Además, la primera energía de ionización es la energía necesaria para eliminar un electrón.
- El segundo es necesario para eliminar dos electrones.
- Las energías de ionización resultantes son siempre mayores que las anteriores.
La química y la energía de ionización
Se refiere a:
- La cantidad mínima de energía que se requiere para el desprendimiento de un electrón en un átomo en fase gaseosa
- Esta energía se suele expresar en unidades de kilojoules por mol.
La energía de ionización, tiene gran importancia en numerosos ámbitos de la química.
Características principales
La energía que se necesita para desprender un electrón que se encuentren un átomo de fase gaseosa destacamos que:
- Éste es el estado del que está libre de la influencia que puedan ejercer los átomos sobre sí mismos.
- Además, en un material que se encuentra en estado gaseoso se descarta cualquier tipo de interacción intermolecular.
- Porque los átomos se encuentran dispersos unos de otros.
- Por otra parte, la magnitud que tiene la energía de ionización.
- Sirve para describir la fuerza con la que un electrón se enlaza al átomo del que forma parte.
- Existirán compuestos donde el electrón tenga una energía de ionización mayor.
- Lo que significa que tiene una mayor fuerza de enlace al átomo.
- Es decir, mientras más grande sea la energía de ionización.
- Más complicado será el desprendimiento del electrón.

Potencial de la energía de ionización
En primer lugar, para estudiar la energía de ionización de una sustancia debemos conocer su potencial de ionización.
Al respecto, el porcentaje de la energía de ionización:
- Es la cantidad mínima de energía que se debe aplicar para causar el desprendimiento de un electrón de la capa más externa del átomo.
- Además, la carga debe ser neutra.
- También, cuando se habla de potencial de ionización se emplea un término que cada vez se usa menos.
- La determinación de esta propiedad se basa en el empleo de un potencial electrostático a la muestra que se quería estudiar.
Mediante el empleo de este potencial electrostático ocurrirán varias cosas:
- Por un lado, la ionización de la especie química tendrá lugar a causa de la acción electrostática.
- Por otro lado, ocurría la aceleración del proceso del desprendimiento del electrón que se desea remover.
Al utilizar técnicas espectroscópicas para la determinación de la energía de ionización:
Se comenzó a modificar el nombre de potencial, por el de energía.
Además, las propiedades químicas que tienen los átomos vienen determinadas por la configuración de los electrones presentes en el nivel energético más externo.
En estos niveles los electrones están más alejados del núcleo y pueden dar más información.
Métodos que permiten determinar la energía de ionización
Existen numerosos métodos de cuantificación de energía de ionización, para determinar la energía de ionización:
- Estos, están dados principalmente por procesos de fotoemisión.
- La mayoría se basan en la determinación de energía que emiten los electrones.
- Como consecuencia de la aplicación del efecto fotoeléctrico.
Entre los métodos podemos mencionar:
En primer lugar, la espectroscopia atómica.
- Este es uno de los métodos más rápidos.
También tenemos la espectroscopia fotoelectrónica.
- En este tipo de método se miden las energías con las que están enlazados los electrones a los átomos.
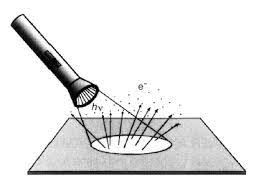
El método, espectroscopia fotoelectrónica ultravioleta:
- Es una técnica emplea la excitación de los átomos o moléculas.
- Mediante la aplicación de la radiación ultravioleta.
- También se utiliza para estudiar las características de los enlaces que forman entre ellos.
El método de espectro copias fotoelectrónica de rayos X:
- Estudia las diferencias en el tipo de radiación que se hace incidir sobre la muestra.
- Además, la velocidad con la que los electrones son expelidos y la resolución obtenida.
