La cetona es un compuesto orgánico caracterizado por componer un grupo funcional carbonilo, cuando el grupo funcional carbonilo es el de mayor relevancia en dicho compuesto, las cetonas se nombran agregando el sufijo -ona al hidrocarburo del cual provienen (hexano, hexanona; heptano, heptanona; etc).
También pueden oxidarse solamente con oxidantes fuertes, produciendo ácidos que tienen un número menor de átomos de carbono. Ante una reacción de reducción, las cetonas generan alcoholes secundarios. Cabe destacar que la reacción de las cetonas y los aldehídos pueden ser de oxidación, reducción o adición nucleofílica. Estas por otra parte, no reaccionan con los reactivos de Schiff, Fehling y Tollens.
Es posible distinguir entre las cetonas aromáticas (como las quinonas), las cetonas alifáticas (entre las cuales se diferencian las cetonas simétricas y las cetonas asimétricas) y las cetonas mixtas (como la fenilmetilbutanona).
Estructura de la cetona
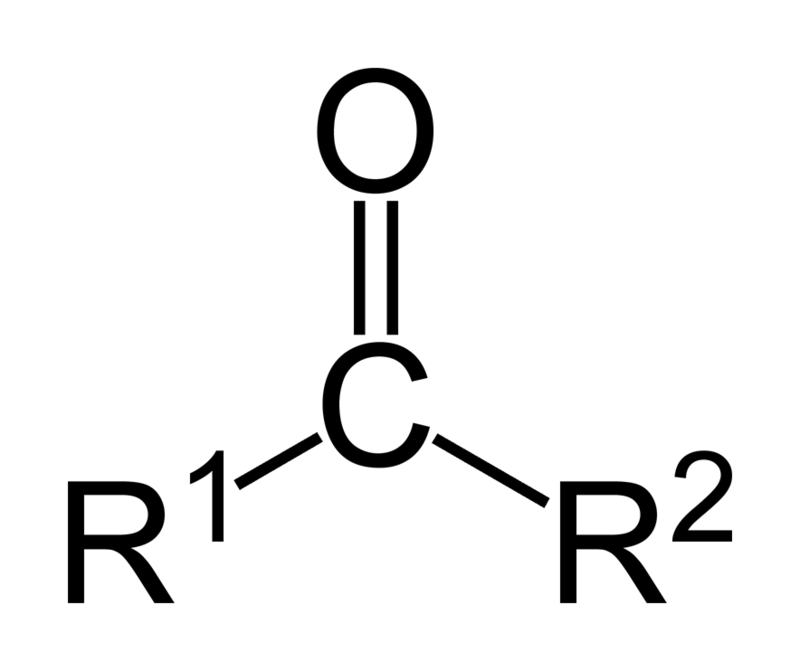
Las cetonas son compuestos que tienen un gran parecido a los aldehídos, poseen el grupo carbonilo (C=O) , con la diferencia que estas en vez de hidrogeno, contiene dos grupos orgánicos como mencionamos anteriormente. Es decir, que luce una estructura de la forma RR’CO, donde se puede presentar que los grupos R y R’ sean alfáticos o aromáticos.
Propiedades físicas y químicas de las cetonas
Las cetonas, como la mayoría de los aldehídos, son moléculas líquidas y presentan una serie de propiedades físicas y químicas que varían dependiendo de la longitud de sus cadenas. Por esto a continuación se describen sus propiedades:
Punto de ebullición de la cetona
Las cetonas son altamente volátiles, considerablemente polares y no pueden donar hidrógenos para enlaces de hidrógeno, por lo que presentan puntos de ebullición más altos que los alquenos y éteres, pero más bajos que los alcoholes de su mismo peso molecular. El punto de ebullición de una cetona aumenta según se incrementa el tamaño de la molécula, esto se debe a la intervención de las fuerzas de van der Waals y la de dipolo-dipolo, las cuales hacen que se requiera una mayor cantidad de energía para separar los átomos y electrones atraídos dentro de esa molécula.
Solubilidad
La solubilidad de las cetonas tiene una fuerte influencia en parte de la capacidad de estas moléculas para aceptar hidrógenos en su átomo de oxígeno y así formar enlace de hidrogeno con el agua. Además, se forman fuerzas de atracción, de dispersión y dipolo-dipolo entre las cetonas y el agua, las cuales incrementan de forma considerable su efecto soluble.
A pesar de esto las cetonas pierden capacidad de solubilidad mientras más grande sea su molécula, ya que comienzan a requerir más energía para disolverse en agua. También son solubles en compuestos orgánicos.
Acidez de la cetona
Debido a su grupo carbonilo, las cetonas poseen una naturaleza ácida; esto sucede por la capacidad de estabilización por resonancia que posee este grupo funcional, el cual puede ceder protones de su doble enlace para formar una base conjugada llamada enol.
Reactividad
Como mencionamos anteriormente las cetonas forman parte de un gran número de reacciones orgánicas; esto ocurre por la susceptibilidad de su carbono carbonilo hacia la adición nucleofílica, además de la polaridad de este. Gracias a la gran reactividad de las cetonas las hace ser un reconocido producto intermedio que sirve de base para sintetizar otros compuestos.
Nomenclatura de la cetona
Además las cetonas se nombran según la prioridad o importancia del grupo carbonilo en la molécula entera, por lo que cuando se tiene una molécula regida por el grupo carbonilo, la cetona se nombra agregando el sufijo “–ona” al nombre del hidrocarburo.
Se toma como cadena principal aquella de mayor longitud que tenga el grupo carbonilo, y luego se nombra la molécula. Si el grupo carbonilo no tiene prioridad sobre los otros grupos funcionales de la molécula, entonces se identifica con “–oxo”.
Para cetonas más complicadas puede identificarse la posición del grupo funcional con un número, y en el caso de dicetonas (cetonas con dos sustituyentes R y R’ idénticos), se nombra la molécula con el sufijo “-diona”. Finalmente, también puede usarse la palabra “cetona” después de identificar las cadenas de radicales unidas al grupo funcional carbonilo.
Estado físico y Olor
Son líquidas las que tienen hasta 10 carbonos, las más grandes suelen ser sólidas. Las pequeñas tienen un olor agradable, las medianas un olor fuerte y no agradable, y las más grandes son inodoras.
Fórmula general de las cetonas
Las cetonas son compuestos carbonilos en los cuales este grupo se encuentra unido a dos grupos de hidrocarburos; estos pueden ser grupos alquilo, grupos de anillos bencenos o ambos. Se puede representar una cetona simplemente como R-(C=O)-R’, donde R y R’ son dos cadenas de hidrocarburo cualquiera (alcanos, alquenos, alquinos, cicloalcanos, derivados del benceno y otros). No existen cetonas con un hidrógeno unido al grupo carbonilo.
El método más común para la síntesis de cetonas involucra la oxidación de hidrocarburos, típicamente con el uso de aire. A pequeña escala, las cetonas se suelen preparar a través de la oxidación de alcoholes secundarios, lo cual da como productos una cetona y agua. Más allá de estos métodos más comunes, las cetonas pueden ser sintetizadas a través de alquenos, alquinos, sales de compuestos nitrogenados, ésteres y muchos otros compuestos, lo cual las hace de fácil obtención.
Tipos de cetonas
Existen varias clasificaciones para las cetonas, dependiendo principalmente de los sustituyentes en sus cadenas R. A continuación se nombran las clasificaciones más comunes para estas sustancias:
La estructura de su cadena
Segun sea la estructura de su cadena la cetona es clasificada: las cetonas alifáticas son aquellas que poseen dos radicales R y R’ que poseen forma de radicales alquilo (alcanos, alquenos, alquinos y cicloalcanos). También las aromáticas son aquellas que forman derivados del benceno, sin dejar de ser cetonas. Por último, las cetonas mixtas son aquellas que poseen un radical R alquílico y un radical R’ arílico, o viceversa.
La simetría de sus radicales
Suelen estudiarse los radicales R y R’ sustituyentes del grupo carbonilo; cuando estos son iguales (idénticos) la cetona se hace llamar simétrica; pero cuando son diferentes (como la mayoría de las cetonas), esta se hace llamar asimétrica.
La saturación de sus radicales
Las cetonas también pueden clasificarse según la saturación de sus cadenas carbonadas; si estas se encuentran en forma de alcanos, la cetona se hace llamar cetona saturada. Pero, si las cadenas se encuentran como alquenos o alquinos, la cetona se llama cetona insaturada.
Dicetonas
Esta es una clase diferente de cetona, puesto que las cadenas de esta cetona poseen dos grupos carbonilo en su estructura. Algunas de estas cetonas poseen características únicas, como una mayor longitud de enlace entre carbonos. Por ejemplo, las dicetonas derivadas del ciclohexano se conocen como quinonas, las cuales son únicamente dos: la orto-benzoquinona y la para-benzoquinona.
Usos de la Cetona
La cetona debido a sus propiedades tienen diferentes usos entre ellos tenemos:
- Algunos medicamentos topicos (Las cremas por ejemplo) contienen cetona
- Para realizar fibras sintéticas (Mayormente utilizada en el interior de los automóviles de gama alta)
- En Fabricación de saborizantes y fragancias
- Elaboración de medicamentos y vitaminas
- Como aditivo para plástico
También una de las formas en las que se le da uso a la cetona y solemos encontrarla es a través de la sustancia natural denominada cetona de frambuesa (la cual también se conoce por su nombre en inglés, raspberry ketone). Se suele usar para complementar tratamientos para perder peso, es decir, es un suplemento dietético ya que tiene diversas propiedades que la vuelven ideal para este propósito.
