
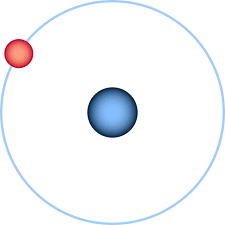
El modelo de Bohr establece que los átomos tienen diferentes configuraciones electrónicas en que los electrones se mueven en órbitas circulares alrededor del núcleo.
- Este modelo se parece al modelo planetario de Copérnico.
- Los planetas describiendo órbitas circulares alrededor del Sol.
- En este caso, los electrones solo pueden orbitar por determinadas órbitas permitidas.
- Los radios de las órbitas no pueden tener cualquier valor.

En 1911, Niels Henrik Bohr propuso el modelo atómico de Bohr.
Además, en otros modelos de átomos anteriores al modelo de Bohr, se afirmó que:
- En el núcleo del átomo había protones cargados (+).
- Y, que circulaban electrones en órbitas circulares alrededor del núcleo.
Por otra parte, Bohr estudió el movimiento de los electrones que orbitan alrededor del núcleo en la teoría atómica.
Erwin Schrödinger descubrió la ecuación fundamental de la mecánica cuántica a partir del modelo atómico de Bohr junto con la dualidad onda-corpúsculo.
Los postulados de la teoría de Bohr
En 1913, Niels Bohr propuso la teoría de Bohr utilizando las líneas espectrales del átomo de hidrógeno y la teoría cuántica de Planck.
A la luz de esta información, los postulados de Bohr se pueden resumir de la siguiente manera:
- Los electrones de un átomo se mueven en órbitas a cierta distancia del núcleo. Cada estado estable tiene una energía constante.
- A cualquier nivel energético estable, el electrón se mueve en una órbita circular. Estas órbitas se denominan niveles de energía o capas.
- Mientras el electrón está en uno de sus estados estacionarios, el átomo no emite luz (radiación).
- Sin embargo, cuando pasa de un nivel de energía alto a un nivel de energía más bajo, emite un cuantos de luz igual a la diferencia de energía entre los niveles.
- Los niveles estables en los que es posible el movimiento de electrones se designan con letras de la K a la Q.
Según el modelo atómico de Bohr, el electrón en movimiento circular al nivel de energía más cercano al núcleo es estable, no emite luz.
Si se le da suficiente energía al electrón, el electrón saltará a un nivel de energía más alto que el nivel de energía en el que se encuentra.
En este estado el átomo es inestable.
Para estabilizarse, el electrón vuelve a su antiguo nivel energético, lanzando un fotón (partícula de rayo / onda) con una energía igual al nivel de energía que recibió.

Errores del modelo atómico de Bohr
- Primero, dado que los electrones son muy rápidos, deben considerarse no solo en la física clásica sino también en la teoría de la relatividad.
- Además, el modelo atómico de Bohr sólo puede explicar los espectros de átomos de un solo electrón (hidrógeno).
- Tampoco, puede explicar los espectros de átomos de varios electrones.
- La dualidad onda-partícula (hipótesis de De Broglie) no se tuvo en cuenta en el modelo atómico de Bohr.
- Según el principio de incertidumbre de Werner Heisenberg, la ubicación y la velocidad del electrón en el átomo no se pueden determinar simultáneamente con absoluta certeza.
- Por tanto, el concepto de «órbita» es erróneo.
- Y, por último, no menciona los neutrones.
Principales aportes
- En primer lugar, el Bohr fue el primero en reconocer el concepto de la mecánica cuántica en la estructura electrónica de un átomo de hidrógeno.
- Además, develó cómo era la estabilidad de los átomos.
- La teoría clásica sostenía que un electrón con carga negativa que orbitaba alrededor de un núcleo (con carga positiva) emitía energía electromagnética, y perdía velocidad hasta caer sobre el núcleo.
- Pero, las pruebas experimentales no evidenciaban el proceso planteado por la teoría clásica.
- Y, a partir del modelo de Bohr y del trabajo de varios físicos más, lograron resolverlo.
En 1916 el físico alemán Arnold Sommerfel optimizó el modelo atómico de Bohr.
Por una parte, estuvo de acuerdo, respecto a que los electrones giraban en órbitas circulares.
- Sin embargo, Sommerfel agregó que, también podían girar en órbitas elípticas más complejas.
Por otra parte, al concepto de mecánica cuántica propuesto por Bohr.
Se le agregó el modelo cuántico no relativista del físico austríaco Erwin Schrödinger, en 1926,
- Al respecto, esta teoría contemplaba a los electrones como ondas estacionarias de materia que tenían probabilidad de estar en un lugar determinado o en otro.
En 1927 los físicos alemanes M. Born y W. Heisenberg:
- Aportaron al concepto de probabilidad de Schrödinger el principio de incertidumbre.
- Este principio, establecía que no se podía conocer de manera simultánea la posición y la velocidad del electrón.
- Y, por lo tanto, no se podía saber su trayectoria con exactitud.
Es importante estacar, que a través de estos aportes de diversos estudios y teorías de otros físicos y matemáticos, se logró: Resolver el dilema planteado por la teoría clásica que resultaba incomprobable desde las pruebas experimentales.
