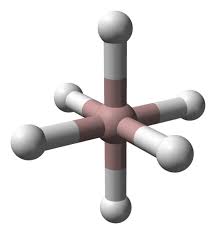
El hidruro de aluminio es un polvo incoloro, blanco o gris, al que se le conoce también como: alane y, hidruro de aluminio (III)
Al hidruro de aluminio se le conoce también con otros nombres:
- Por una parte le llaman trihidruro de aluminio
- y, también, trihidrido aluminio
Esta sustancia se obtiene mediante el tratamiento de hidruro de litio y aluminio LiAlH 4.con cloruro de aluminio AlCl 3 eliminando cuidadosamente el cloruro de litio LiCl: 3 LiAlH 4+ AlCl 3⟶ 4 AlH 3+ 3 LiCl.
Hidruro de aluminio (AlH3): estructura, propiedades
El hidruro de aluminio es un compuesto inorgánico cuya fórmula química es AlH3.
Aunque parezca de naturaleza simple, en realidad se trata de una sustancia un tanto confusa.
A causa del brillo cristalino que puede presentarse en su sólido, suele tomarse como un hidruro iónico, formado por iones Al3+ y H–.
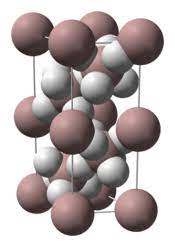
Sin embargo, de acuerdo con sus propiedades:
- En primer lugar, es un sólido polimérico.
- Su representación más fiel vendría a ser del tipo (AlH3)n, siendo n el número de unidades monoméricas AlH3 que integraría una cadena o capa del cristal.
- Por lo tanto, el AlH3 es uno de esos polímeros que logra adoptar una estructura cristalina.
Usos de esta sustancia
Se destina especialmente para síntesis orgánicas, donde sirve como un poderoso agente reductor.
Asimismo, ocupa un lugar especial en el avance tecnológico de materiales, siendo una alternativa prometedora para el almacenaje de hidrógeno.
Entre las aplicaciones en las que interviene la sustancia se encuentran:
.- Sirve como agente reductor en grupos funcionales ya que es un reactivo químico.
.-Para almacenar el hidrógeno en vehículos.
.-En la industria pirotécnica.
El hidruro de aluminio, preparación
Es importante destacar, que los hidruros de aluminio y varios complejos de los mismos se conocen desde hace mucho tiempo.
Por otra parte, su primera síntesis se publicó en 1947 y se asignó una patente para la síntesis en 1999.
En todo caso, la sustancia se prepara:
- Tratando hidruro de litio y aluminio con tricloruro de aluminio.
- El procedimiento es complejo: se debe prestar atención a la eliminación del cloruro de litio.
El hidruro de aluminio y su síntesis electroquímica
Podemos destacar, que varios grupos han demostrado que el alano se puede producir electroquímicamente.
Se han patentado diferentes métodos electroquímicos de producción de alanos.
La generación electroquímica de alano evita las impurezas de cloruro.
Se ha demostrado la cristalización y recuperación de hidruro de aluminio a partir de alano generado electroquímicamente.
Hidrogenación a alta presión de aluminio metálico
El α-AlH 3 se puede producir mediante la hidrogenación de aluminio metálico a 10 GPa y 600 ° C (1,112 ° F).
La reacción entre el hidrógeno licuado produce α-AlH 3 que podría recuperarse en condiciones ambientales.
Reacciones del hidruro de aluminio
Formación de aductos con bases de Lewis
AlH 3 forma fácilmente aductos con fuertes bases de Lewis . Por ejemplo, ambos complejos 1: 1 y 1: 2 se forman con trimetilamina .
- El complejo 1: 1 es tetraédrico en la fase gaseosa, pero en la fase sólida es dimérico con centros de hidrógeno puente, (NMe 3 Al (μ-H)) 2.
- El complejo 1: 2 adopta una estructura bipiramidal trigonal.
Algunos aductos (por ejemplo, dimetiletilamina alano, NMe 2 Et · AlH 3 ) se descomponen térmicamente para dar aluminio metálico y pueden tener uso en aplicaciones MOCVD .
Por otra parte, su complejo con éter dietílico se forma según la siguiente estequiometría:
AlH 3 + (C 2 H 5 ) 2 O → H 3 Al · O (C 2 H 5 ) 2
La reacción con hidruro de litio en éter produce hidruro de litio y aluminio:
AlH 3 + LiH → LiAlH 4
Reducción de grupos funcionales
En química orgánica, la sustancia se utiliza principalmente para la reducción de grupos funcionales.
En muchos sentidos, la reactividad del hidruro de aluminio es similar a la del hidruro de litio y aluminio.
Además reducirá:
- Los aldehídos.
- Cetonas.
- Ácidos carboxílicos.
- Anhídridos.
- Cloruros de ácido.
- Ésteres.
- Y, lactonas a sus correspondientes alcoholes.
Y, por su parte:
- Las amidas.
- Los nitrilos.
- Y, las oximas se reducen a sus correspondientes aminas.
Por otra parte, esta sustancia incluso reduce el dióxido de carbono a metano bajo calentamiento:
- 4 AlH 3 + 3 CO 2 → 3 CH 4 + 2 Al 2 O 3
Hidroaluminación
- Se ha demostrado que el hidruro de aluminio se agrega a los alcoholes propargílicos.
- Usado junto con tetracloruro de titanio, se puede agregar a través de dobles enlaces.
- La hidroboración es una reacción similar.
